よむ、つかう、まなぶ。
【資料3】日米欧における医薬品の品質管理・製造管理に関する調査の状況(令和4年度欧米の薬事制度に関する調査・整理業務 調査結果) (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30030.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第10回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
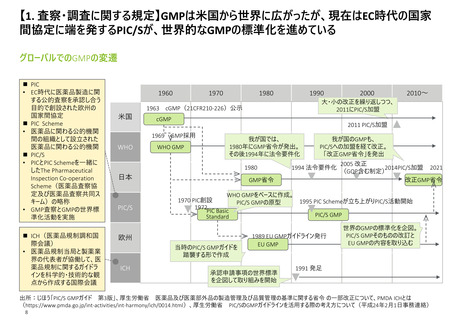
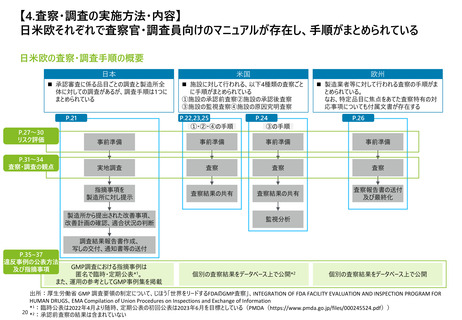
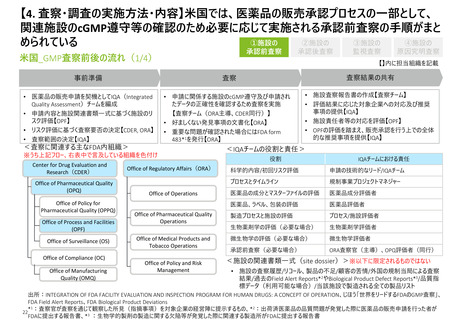
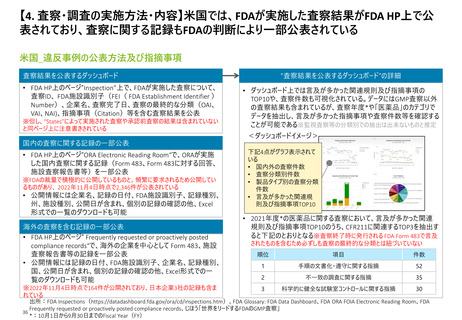
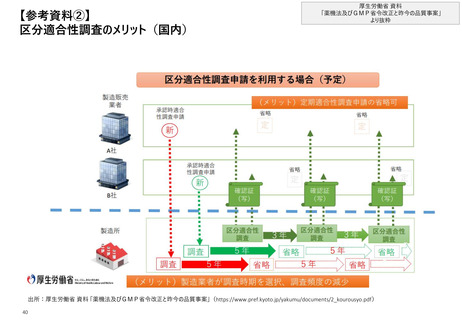
【2. 査察・調査の分類】米国では、実地で行われるGMP査察は、施設の承認前査察、承
認後査察、監視査察、原因究明査察の4つに大別される
米国_実施契機に応じた分類
❶施設の承認前査察(Pre-Approval Facility Inspection)
• 品質の観点から、医薬品の販売承認を行う上で必要と判断された際に、医薬品の販売申請時に言及されている施設に対し
て行われる査察
※FDAは施設への通知有無に関わらず査察を行う権利を有するが、販売申請対象の製品が製造されている時に査察を行う
必要があると判断した場合には、施設側が製造スケジュールを調整できるよう少なくとも査察の60日前に事前に通告をする
❷施設の承認後査察(Post-Approval Facility Inspection)
GMP査察
※①以外の査察については、
事前通告についての規定は
確認できていない
• 医薬品の承認後(または一部承認プロセス中)、“①施設の承認前査察”を踏まえての残存リスク(residual risk)や、承
認後の製造工程の変化を踏まえて、申請時点の情報が遵守され、cGMPの要求を満たしているかを確認するために実施され
る査察
※承認後に発生した可能性のある製造上の変更点に焦点を当てており、承認前査察が必要ないとみなされた場合でも、認
識されたリスクの変化によって承認後査察を開始する可能性がある
❸施設の監視査察(Surveillance Facility Inspection)
• cGMPの遵守状況を監視し、施設における品質上の問題や好ましくない傾向を特定するための定期的な査察
(頻度は”リスクベースの施設選択モデル(SSM)”で決定*)
❹施設の原因究明査察(For-Cause Facility Inspection)
• 製造方法や施設、プロセス、または医薬品の品質に関して懸念を生じる特定の事象や情報があった際に、販売されている医
薬品の品質や措置の要否を判断するために行われる査察
※執行措置が行われた後の是正対応を検証するためのフォローアップとして査察が行われる場合もある
出所:FDA INTEGRATION OF FDA FACILITY EVALUATION AND INSPECTION PROGRAM FOR HUMAN DRUGS: A CONCEPT OF OPERATION、 FDA Approached to GMP
inspection、じほう「世界をリードするFDAのGMP査察」、FDA Drug Compliance Programs Preapproval Inspections
14
*: SSMの内容は、後続資料「米国_リスク評価」にて述べる
認後査察、監視査察、原因究明査察の4つに大別される
米国_実施契機に応じた分類
❶施設の承認前査察(Pre-Approval Facility Inspection)
• 品質の観点から、医薬品の販売承認を行う上で必要と判断された際に、医薬品の販売申請時に言及されている施設に対し
て行われる査察
※FDAは施設への通知有無に関わらず査察を行う権利を有するが、販売申請対象の製品が製造されている時に査察を行う
必要があると判断した場合には、施設側が製造スケジュールを調整できるよう少なくとも査察の60日前に事前に通告をする
❷施設の承認後査察(Post-Approval Facility Inspection)
GMP査察
※①以外の査察については、
事前通告についての規定は
確認できていない
• 医薬品の承認後(または一部承認プロセス中)、“①施設の承認前査察”を踏まえての残存リスク(residual risk)や、承
認後の製造工程の変化を踏まえて、申請時点の情報が遵守され、cGMPの要求を満たしているかを確認するために実施され
る査察
※承認後に発生した可能性のある製造上の変更点に焦点を当てており、承認前査察が必要ないとみなされた場合でも、認
識されたリスクの変化によって承認後査察を開始する可能性がある
❸施設の監視査察(Surveillance Facility Inspection)
• cGMPの遵守状況を監視し、施設における品質上の問題や好ましくない傾向を特定するための定期的な査察
(頻度は”リスクベースの施設選択モデル(SSM)”で決定*)
❹施設の原因究明査察(For-Cause Facility Inspection)
• 製造方法や施設、プロセス、または医薬品の品質に関して懸念を生じる特定の事象や情報があった際に、販売されている医
薬品の品質や措置の要否を判断するために行われる査察
※執行措置が行われた後の是正対応を検証するためのフォローアップとして査察が行われる場合もある
出所:FDA INTEGRATION OF FDA FACILITY EVALUATION AND INSPECTION PROGRAM FOR HUMAN DRUGS: A CONCEPT OF OPERATION、 FDA Approached to GMP
inspection、じほう「世界をリードするFDAのGMP査察」、FDA Drug Compliance Programs Preapproval Inspections
14
*: SSMの内容は、後続資料「米国_リスク評価」にて述べる