よむ、つかう、まなぶ。
【資料3】日米欧における医薬品の品質管理・製造管理に関する調査の状況(令和4年度欧米の薬事制度に関する調査・整理業務 調査結果) (37 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30030.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第10回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
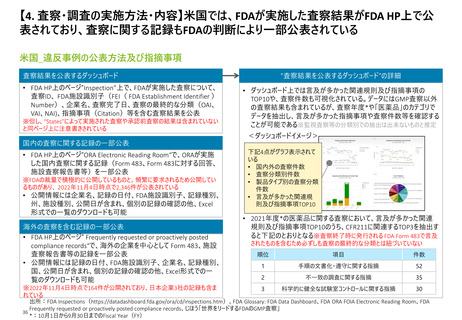
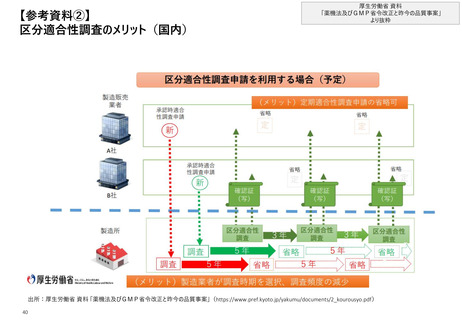
【4. 査察・調査の実施方法・内容】欧州では、EMAのデータベース上で各製造業者のGMP
証明書、GMP不遵守レポートのいずれも公表されている
欧州_違反事例の公表方法及び指摘事項
“GMP不遵守レポート”のうち、2021年に査察が実施された
5件に対する具体的な指摘事項
GMP証明書又はGMP不遵守の旨を公表
• EMAがHP上でデータベース“EudraGMDP”を公表しており、各製造業
者のGMP証明書、GMP不遵守レポートのいずれも確認可能
※査察分類や事前通告有無での区別はされていない
いずれの事例でも下記のとおり複数の指摘がなされている
※③~⑤は同企業の別々の製造所に対して行われたものであるが、いずれの製
造所においても同様にGMPが遵守できていなかった状況が見て取れる
<EudraGMDP画面イメージ>
GMP証明書は、国名欄
(Country)のプルダウンか
ら検索したい国を選び
Searchボタンを押すと結果
が一覧として表示される
GMP不遵守レポートは期間
を指定するとその指定期間
中のレポート一覧が表示さ
れる
出所:EudraGMDP(http://eudragmdp.ema.europa.eu/inspections/gmpc/index.do)
37
No.
対象
指摘事項
①
A社
過去の交差汚染問題に加え、査察の際に製造プロセスが十
分にコントロールされていることを示せなかった
②
B社
重大な指摘事項が3点確認された
• バイオハザードリスクがあるため処分されることとなった血漿ユ
ニットの取り扱いが安全でなかった
• 血漿管理のために使用されていたITソフトウェアがシステムの
複雑性に応じて検証されていなかった
• 紙ベースの記録が、管理された専用の場所に保管されてい
なかった
③
C社
-施設a
保管と製造のための部屋が適切に分けられていない、ペストコ
ントロールがなされていない、衛生環境が悪い、水供給システム
が適切にメンテナンスされていない等多数の不備が発見された
④
C社
-施設b
ペストコントロールがなされていない、衛生環境が悪い、適切な
温度管理がされていない等多数の不備発見された
⑤
C社
-施設c
保管と製造のための部屋が適切に分けられていない、ペストコ
ントロールがなされていない、衛生環境が悪い、水供給システム
が適切にメンテナンスされていない等多数の不備が発見された
証明書、GMP不遵守レポートのいずれも公表されている
欧州_違反事例の公表方法及び指摘事項
“GMP不遵守レポート”のうち、2021年に査察が実施された
5件に対する具体的な指摘事項
GMP証明書又はGMP不遵守の旨を公表
• EMAがHP上でデータベース“EudraGMDP”を公表しており、各製造業
者のGMP証明書、GMP不遵守レポートのいずれも確認可能
※査察分類や事前通告有無での区別はされていない
いずれの事例でも下記のとおり複数の指摘がなされている
※③~⑤は同企業の別々の製造所に対して行われたものであるが、いずれの製
造所においても同様にGMPが遵守できていなかった状況が見て取れる
<EudraGMDP画面イメージ>
GMP証明書は、国名欄
(Country)のプルダウンか
ら検索したい国を選び
Searchボタンを押すと結果
が一覧として表示される
GMP不遵守レポートは期間
を指定するとその指定期間
中のレポート一覧が表示さ
れる
出所:EudraGMDP(http://eudragmdp.ema.europa.eu/inspections/gmpc/index.do)
37
No.
対象
指摘事項
①
A社
過去の交差汚染問題に加え、査察の際に製造プロセスが十
分にコントロールされていることを示せなかった
②
B社
重大な指摘事項が3点確認された
• バイオハザードリスクがあるため処分されることとなった血漿ユ
ニットの取り扱いが安全でなかった
• 血漿管理のために使用されていたITソフトウェアがシステムの
複雑性に応じて検証されていなかった
• 紙ベースの記録が、管理された専用の場所に保管されてい
なかった
③
C社
-施設a
保管と製造のための部屋が適切に分けられていない、ペストコ
ントロールがなされていない、衛生環境が悪い、水供給システム
が適切にメンテナンスされていない等多数の不備が発見された
④
C社
-施設b
ペストコントロールがなされていない、衛生環境が悪い、適切な
温度管理がされていない等多数の不備発見された
⑤
C社
-施設c
保管と製造のための部屋が適切に分けられていない、ペストコ
ントロールがなされていない、衛生環境が悪い、水供給システム
が適切にメンテナンスされていない等多数の不備が発見された