よむ、つかう、まなぶ。
【参考資料6】成人と合わせて評価可能な小児(10歳又は12歳以上の小児)の臨床評価の留意点について(令和2年6月30日医薬品審査管理課事務連絡) (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00028.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第1回 7/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
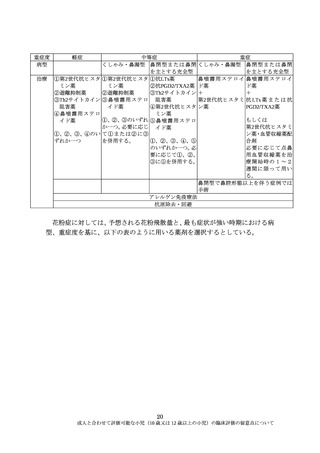
成人と合わせて評価可能な小児(10 歳又は 12 歳以上の小児)の臨床評価の留
意点について
Ⅰ. 総論
1. 背景及び目的
医薬品の開発では、一般的に成人を対象にした開発を先行させ、小児の用
法・用量の開発は成人の開発後に行われる。また、小児の用法・用量の開発
は、臨床試験の実施が難しい場合や、市場規模が小さいなど経済的な理由か
ら、進みにくい状況もある。そのため、小児に必要な医薬品の用法・用量の開
発が進まず、小児の用法・用量が承認されていない状況下で、臨床使用され
ているものもある。
一方、小児を対象とした臨床試験に基づき用法・用量が設定された医薬品
では、12 歳以上の小児などに対し、成人と同一の用法・用量が承認されてい
る事例も見られる。また、多数の小児患者が存在する疾患を対象としたもの
を除き、非盲検非対照試験や、登録症例数が少ない等、得られている情報は
限られているものもある。また、小児で多数の患者が存在する疾患において
は、同一疾患を対象としているにもかかわらず、臨床試験で組入れられた年
齢区分が開発薬剤によって異なった結果として、薬剤ごとに投与対象となる
小児の年齢区分が異なり、医療現場での使用に注意を要する場合もある。
国際的には、医薬品規制調和国際会議(ICH;the International Council for
Harmonisation of Technical Requirements for Registration of Pharmaceuticals for
Human Use)において、小児集団に対する臨床試験に関する考え方を作成し、
計画開始時の問題点、開始時期、試験の種類、年齢区分などが記載されてい
る 1),2),3)。小児医薬品の開発促進を目指し、米国食品医薬品局(FDA)は、昨
年、抗悪性腫瘍薬の臨床評価に関し、病理学的、生物学的特徴が成人と
Adolescents で類似していると考えられる悪性腫瘍については、Adolescents を
成人の臨床試験に含めるべきとするガイダンス案を公表している 4)
このような背景から、小児を対象とした医薬品の臨床開発の一層の効率化、
適正化を図ることを目的として、成人と合わせて評価可能な小児の年齢層及
び疾患について、臨床評価の留意点を取りまとめた。
なお、この留意点は現時点での原則的な考え方をまとめたものであり、個
別事例によってはこの留意点に示された考え方が当てはまらない場合もあり
得る。また、対象とした疾患に用いられる薬剤すべてで成人と小児を合わせ
て評価することを求めるものではなく、小児用医薬品の開発計画により成人
における臨床試験の完了や成人用医薬品の臨床使用が遅れることがあっては
1
成人と合わせて評価可能な小児(10 歳又は 12 歳以上の小児)の臨床評価の留意点について
意点について
Ⅰ. 総論
1. 背景及び目的
医薬品の開発では、一般的に成人を対象にした開発を先行させ、小児の用
法・用量の開発は成人の開発後に行われる。また、小児の用法・用量の開発
は、臨床試験の実施が難しい場合や、市場規模が小さいなど経済的な理由か
ら、進みにくい状況もある。そのため、小児に必要な医薬品の用法・用量の開
発が進まず、小児の用法・用量が承認されていない状況下で、臨床使用され
ているものもある。
一方、小児を対象とした臨床試験に基づき用法・用量が設定された医薬品
では、12 歳以上の小児などに対し、成人と同一の用法・用量が承認されてい
る事例も見られる。また、多数の小児患者が存在する疾患を対象としたもの
を除き、非盲検非対照試験や、登録症例数が少ない等、得られている情報は
限られているものもある。また、小児で多数の患者が存在する疾患において
は、同一疾患を対象としているにもかかわらず、臨床試験で組入れられた年
齢区分が開発薬剤によって異なった結果として、薬剤ごとに投与対象となる
小児の年齢区分が異なり、医療現場での使用に注意を要する場合もある。
国際的には、医薬品規制調和国際会議(ICH;the International Council for
Harmonisation of Technical Requirements for Registration of Pharmaceuticals for
Human Use)において、小児集団に対する臨床試験に関する考え方を作成し、
計画開始時の問題点、開始時期、試験の種類、年齢区分などが記載されてい
る 1),2),3)。小児医薬品の開発促進を目指し、米国食品医薬品局(FDA)は、昨
年、抗悪性腫瘍薬の臨床評価に関し、病理学的、生物学的特徴が成人と
Adolescents で類似していると考えられる悪性腫瘍については、Adolescents を
成人の臨床試験に含めるべきとするガイダンス案を公表している 4)
このような背景から、小児を対象とした医薬品の臨床開発の一層の効率化、
適正化を図ることを目的として、成人と合わせて評価可能な小児の年齢層及
び疾患について、臨床評価の留意点を取りまとめた。
なお、この留意点は現時点での原則的な考え方をまとめたものであり、個
別事例によってはこの留意点に示された考え方が当てはまらない場合もあり
得る。また、対象とした疾患に用いられる薬剤すべてで成人と小児を合わせ
て評価することを求めるものではなく、小児用医薬品の開発計画により成人
における臨床試験の完了や成人用医薬品の臨床使用が遅れることがあっては
1
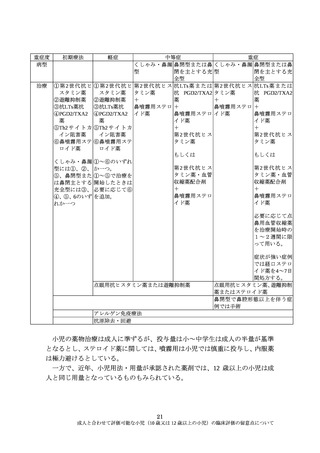
成人と合わせて評価可能な小児(10 歳又は 12 歳以上の小児)の臨床評価の留意点について