よむ、つかう、まなぶ。
【参考資料6】成人と合わせて評価可能な小児(10歳又は12歳以上の小児)の臨床評価の留意点について(令和2年6月30日医薬品審査管理課事務連絡) (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00028.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第1回 7/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(3)成人と合わせて開発が可能と考える理由
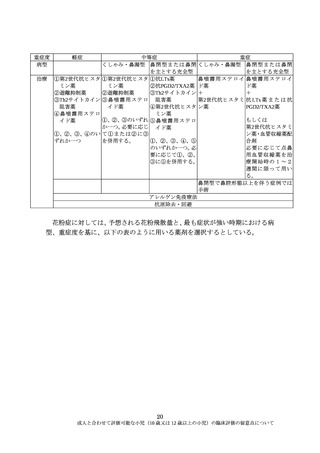
アレルギー性鼻炎は鼻粘膜の I 型アレルギー性疾患で、成因は成人と小児で同
様と考えられる。小児期発症のアレルギー性鼻炎の自然治癒は比較的低率で遅
いとされ、この場合、思春期も含めて成人期まで治療が必要となる。また、小児
の薬物治療は成人に準ずるとされている。
臨床評価における主要評価項目について、症状スコアなど患者評価指標を用
いる場合は、小児の精神・心理面での発達段階を踏まえて、被験者自身の評価の
実施可能性及び適切性についても成人との異同を考慮することが必要となるが、
小児(10 歳又は 12 歳以上の小児)においては、成人と同じ評価指標で臨床試験
を行うことは可能と考えられる。
以上から、小児(10歳又は12歳以上の小児)においては、成人と合わせて開発
することは可能である。
なお、EMAは、小児一般の免疫学的治療では小児集団での有効性、安全性の
評価が必要としているが、青少年は成人と合わせて臨床試験を行うことが可能
としている2)。また、近年日本において開発された薬剤において、主要な試験が
12歳以上の小児と成人を同一の試験で評価したものもみられている。
(4)対象となる年齢層について
本留意点では、総論「2.対象年齢について」の項で記載したとおり、成人の
用法・用量と同一、又はその範囲内となることが想定され、かつ、同一製剤を使
用できる小児の年齢を想定し、原則 10 歳や 12 歳以上としている。
アレルギー性鼻炎については、小児の低年齢の小児の患者も多く、小児の幅広
い年齢層での用法・用量の開発が求められること、また、近年、国際共同で開発
が進められる可能性があることを考慮すると、対象となる年齢層については原
則 12 歳以上とすることが妥当と考えられる。なお、用法・用量や安全域など薬
剤特性によっては、より低年齢小児を臨床試験の対象にできる場合もある。この
場合は、評価方法など、より低年齢小児を含めて評価することの妥当性を説明す
る必要がある。
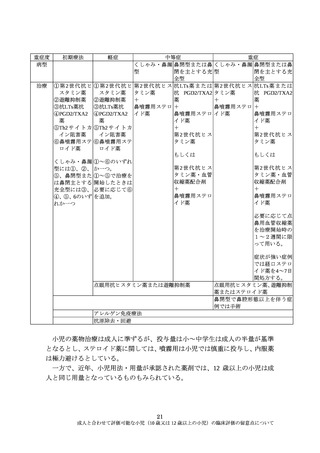
(5)臨床評価方法
本留意点の対象は、原則、成人の用法・用量が設定されたのち、成人と同一、
または成人の用法・用量の範囲内となる小児集団に対する臨床評価の考え方で
あり、小児の臨床データの取得は、主に、検証的臨床試験、あるいは、長期投与
試験によるものとなる。
アレルギー性鼻炎は 12 歳以上においても一定規模の数の患者が存在すること
から、これらの年齢層を一定数成人の検証的試験に組入れ、市販前に薬物動態、
有効性、安全性に関する情報を取得することが必要である。特に、局所投与薬な
22
成人と合わせて評価可能な小児(10 歳又は 12 歳以上の小児)の臨床評価の留意点について
アレルギー性鼻炎は鼻粘膜の I 型アレルギー性疾患で、成因は成人と小児で同
様と考えられる。小児期発症のアレルギー性鼻炎の自然治癒は比較的低率で遅
いとされ、この場合、思春期も含めて成人期まで治療が必要となる。また、小児
の薬物治療は成人に準ずるとされている。
臨床評価における主要評価項目について、症状スコアなど患者評価指標を用
いる場合は、小児の精神・心理面での発達段階を踏まえて、被験者自身の評価の
実施可能性及び適切性についても成人との異同を考慮することが必要となるが、
小児(10 歳又は 12 歳以上の小児)においては、成人と同じ評価指標で臨床試験
を行うことは可能と考えられる。
以上から、小児(10歳又は12歳以上の小児)においては、成人と合わせて開発
することは可能である。
なお、EMAは、小児一般の免疫学的治療では小児集団での有効性、安全性の
評価が必要としているが、青少年は成人と合わせて臨床試験を行うことが可能
としている2)。また、近年日本において開発された薬剤において、主要な試験が
12歳以上の小児と成人を同一の試験で評価したものもみられている。
(4)対象となる年齢層について
本留意点では、総論「2.対象年齢について」の項で記載したとおり、成人の
用法・用量と同一、又はその範囲内となることが想定され、かつ、同一製剤を使
用できる小児の年齢を想定し、原則 10 歳や 12 歳以上としている。
アレルギー性鼻炎については、小児の低年齢の小児の患者も多く、小児の幅広
い年齢層での用法・用量の開発が求められること、また、近年、国際共同で開発
が進められる可能性があることを考慮すると、対象となる年齢層については原
則 12 歳以上とすることが妥当と考えられる。なお、用法・用量や安全域など薬
剤特性によっては、より低年齢小児を臨床試験の対象にできる場合もある。この
場合は、評価方法など、より低年齢小児を含めて評価することの妥当性を説明す
る必要がある。
(5)臨床評価方法
本留意点の対象は、原則、成人の用法・用量が設定されたのち、成人と同一、
または成人の用法・用量の範囲内となる小児集団に対する臨床評価の考え方で
あり、小児の臨床データの取得は、主に、検証的臨床試験、あるいは、長期投与
試験によるものとなる。
アレルギー性鼻炎は 12 歳以上においても一定規模の数の患者が存在すること
から、これらの年齢層を一定数成人の検証的試験に組入れ、市販前に薬物動態、
有効性、安全性に関する情報を取得することが必要である。特に、局所投与薬な
22
成人と合わせて評価可能な小児(10 歳又は 12 歳以上の小児)の臨床評価の留意点について