よむ、つかう、まなぶ。
【参考資料6】成人と合わせて評価可能な小児(10歳又は12歳以上の小児)の臨床評価の留意点について(令和2年6月30日医薬品審査管理課事務連絡) (24 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00028.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第1回 7/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
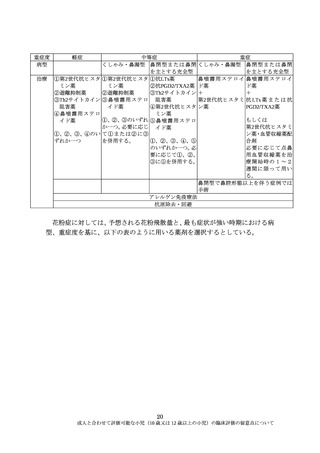
ど薬物動態による解釈に限界があるものは有効性、安全性の情報がより重要と
なる。12 歳以上の小児は、成人と同様に評価することが可能と考えられること
から、小児集団のみで統計学的な検証を行うことは必須ではない。ただし、可能
な限り部分集団解析を実施するなどして、12 歳以上の小児と成人の有効性、安
全性及び薬物動態を比較し、用法・用量の妥当性を確認しておくことは重要であ
る。また、小児においても長期の安全性の情報を収集しておくことは有益であり、
長期試験の対象にも 12 歳以上の小児を含めるべきである。
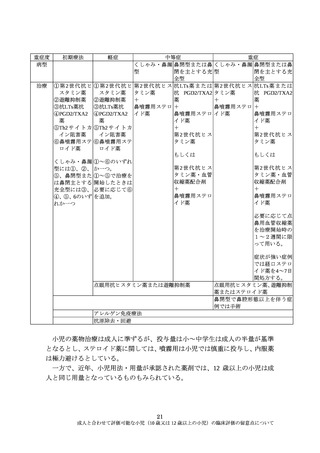
(6)市販後の情報収集
アレルギー性鼻炎では、原則、臨床試験において小児の有効性、安全性のデー
タが一定数得られ、承認時点で評価される。したがって、製造販売後調査におい
ては、薬剤ごとに、承認前に得られている情報を考慮して、情報収集の内容、範
囲を判断する。
(7)その他の留意点
アレルギー性鼻炎に対するステロイド内服薬は極力避けるなどの注意がされ
ているところであり、開発にあたっても、副作用などの影響を考慮し、その妥当
性を慎重に検討することが必要である。
Reference:
1) 鼻アレルギー診療ガイドライン-通年性鼻炎と花粉症- 2016 年版(改訂第 8
版)
2) Guideline on the clinical development of products for specific immunotherapy for
the treatment of allergic diseases. CHMP/EWP/18504/2006, 2008
23
成人と合わせて評価可能な小児(10 歳又は 12 歳以上の小児)の臨床評価の留意点について
なる。12 歳以上の小児は、成人と同様に評価することが可能と考えられること
から、小児集団のみで統計学的な検証を行うことは必須ではない。ただし、可能
な限り部分集団解析を実施するなどして、12 歳以上の小児と成人の有効性、安
全性及び薬物動態を比較し、用法・用量の妥当性を確認しておくことは重要であ
る。また、小児においても長期の安全性の情報を収集しておくことは有益であり、
長期試験の対象にも 12 歳以上の小児を含めるべきである。
(6)市販後の情報収集
アレルギー性鼻炎では、原則、臨床試験において小児の有効性、安全性のデー
タが一定数得られ、承認時点で評価される。したがって、製造販売後調査におい
ては、薬剤ごとに、承認前に得られている情報を考慮して、情報収集の内容、範
囲を判断する。
(7)その他の留意点
アレルギー性鼻炎に対するステロイド内服薬は極力避けるなどの注意がされ
ているところであり、開発にあたっても、副作用などの影響を考慮し、その妥当
性を慎重に検討することが必要である。
Reference:
1) 鼻アレルギー診療ガイドライン-通年性鼻炎と花粉症- 2016 年版(改訂第 8
版)
2) Guideline on the clinical development of products for specific immunotherapy for
the treatment of allergic diseases. CHMP/EWP/18504/2006, 2008
23
成人と合わせて評価可能な小児(10 歳又は 12 歳以上の小児)の臨床評価の留意点について