よむ、つかう、まなぶ。
【参考資料6】成人と合わせて評価可能な小児(10歳又は12歳以上の小児)の臨床評価の留意点について(令和2年6月30日医薬品審査管理課事務連絡) (26 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00028.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第1回 7/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
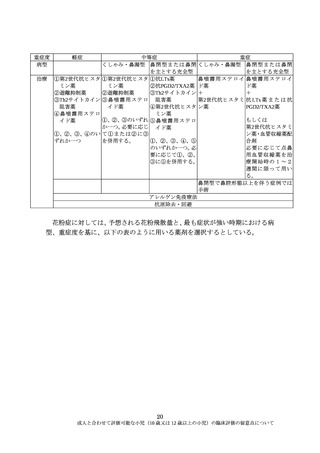
性によっては、より低年齢小児を臨床試験の対象に含めることができる場合も
ある。この場合は、評価方法など、より低年齢小児を含めて評価することの妥
当性を説明する必要がある。
例えば、抗インフルエンザウイルス治療薬では、現在、ウイルス増殖に必要
なノイラミニダーゼやキャップ依存性エンドヌクレアーゼの活性を阻害する薬
剤が本邦で承認されている。インフルエンザウイルス感染症の成因、抗インフ
ルエンザウイルス薬のインフルエンザウイルスへの作用機構は成人と小児と同
様と考えられる。一方で、インフルエンザウイルスに対する獲得免疫は、過去
の罹患により影響すると考えられるが、小児(10歳又は12歳以上の小児)につ
いては一般的にはインフルエンザウイルス感染症の罹患歴を有していると考え
られ、成人と同様に有効性の評価ができると考えられる。
近年、本邦で小児用法・用量が承認された抗インフルエンザウイルス薬に関す
る主要な臨床試験においては、10 歳あるいは 12 歳以上の小児を成人の試験に組
入れて臨床評価を行っている。
なお、FDA は、抗インフルエンザウイルス薬の開発に関して、成人と小児で
過去の罹患による免疫能がインフルエンザウイルス感染症の病態に影響する可
能性や、ウイルス排泄が成人と小児で異なる可能性を指摘し、特に 12 歳未満の
小児については臨床的有効性指標や安全性についての試験が必要としている。
一方で、Adolescent については個々の薬剤の薬理作用により成人の試験に組み込
むことも可能としている 2)。
抗菌薬についても、EMA、FDA が小児臨床評価に関し以下の考え方を示して
いる。
EMA はいくつかの例外を除き、抗菌薬は成人の有効性を小児全体に外挿する
ことが可能と考えられること、多くの場合で小児の薬物動態試験だけが求めら
れるとしている 3)。
FDA は院内肺炎に対する抗菌薬の臨床評価に関し、小児への有効性の外挿は
一般的に受け入れられるが、至適用量の決定や安全性の評価には小児対象の臨
床試験が求められるとしている。
(4)臨床評価方法
本留意点の対象は、原則、成人の用法・用量が設定されたのち、成人と同一、
または成人の用法・用量の範囲内となる小児集団に対する臨床評価の考え方で
あり、小児の臨床データの取得は、主に、検証的臨床試験、あるいは、長期投与
試験によるものとなる。
感染症では罹患する患者数の異なる様々な疾患があり、疾患に合わせて小児
に対する臨床データの必要性を考えることが適切である。一般的には、12 歳以
25
成人と合わせて評価可能な小児(10 歳又は 12 歳以上の小児)の臨床評価の留意点について
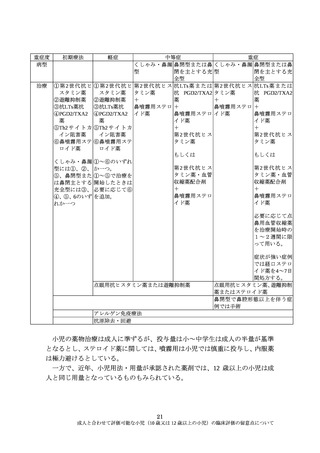
ある。この場合は、評価方法など、より低年齢小児を含めて評価することの妥
当性を説明する必要がある。
例えば、抗インフルエンザウイルス治療薬では、現在、ウイルス増殖に必要
なノイラミニダーゼやキャップ依存性エンドヌクレアーゼの活性を阻害する薬
剤が本邦で承認されている。インフルエンザウイルス感染症の成因、抗インフ
ルエンザウイルス薬のインフルエンザウイルスへの作用機構は成人と小児と同
様と考えられる。一方で、インフルエンザウイルスに対する獲得免疫は、過去
の罹患により影響すると考えられるが、小児(10歳又は12歳以上の小児)につ
いては一般的にはインフルエンザウイルス感染症の罹患歴を有していると考え
られ、成人と同様に有効性の評価ができると考えられる。
近年、本邦で小児用法・用量が承認された抗インフルエンザウイルス薬に関す
る主要な臨床試験においては、10 歳あるいは 12 歳以上の小児を成人の試験に組
入れて臨床評価を行っている。
なお、FDA は、抗インフルエンザウイルス薬の開発に関して、成人と小児で
過去の罹患による免疫能がインフルエンザウイルス感染症の病態に影響する可
能性や、ウイルス排泄が成人と小児で異なる可能性を指摘し、特に 12 歳未満の
小児については臨床的有効性指標や安全性についての試験が必要としている。
一方で、Adolescent については個々の薬剤の薬理作用により成人の試験に組み込
むことも可能としている 2)。
抗菌薬についても、EMA、FDA が小児臨床評価に関し以下の考え方を示して
いる。
EMA はいくつかの例外を除き、抗菌薬は成人の有効性を小児全体に外挿する
ことが可能と考えられること、多くの場合で小児の薬物動態試験だけが求めら
れるとしている 3)。
FDA は院内肺炎に対する抗菌薬の臨床評価に関し、小児への有効性の外挿は
一般的に受け入れられるが、至適用量の決定や安全性の評価には小児対象の臨
床試験が求められるとしている。
(4)臨床評価方法
本留意点の対象は、原則、成人の用法・用量が設定されたのち、成人と同一、
または成人の用法・用量の範囲内となる小児集団に対する臨床評価の考え方で
あり、小児の臨床データの取得は、主に、検証的臨床試験、あるいは、長期投与
試験によるものとなる。
感染症では罹患する患者数の異なる様々な疾患があり、疾患に合わせて小児
に対する臨床データの必要性を考えることが適切である。一般的には、12 歳以
25
成人と合わせて評価可能な小児(10 歳又は 12 歳以上の小児)の臨床評価の留意点について