よむ、つかう、まなぶ。
【参考資料6】成人と合わせて評価可能な小児(10歳又は12歳以上の小児)の臨床評価の留意点について(令和2年6月30日医薬品審査管理課事務連絡) (32 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00028.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第1回 7/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
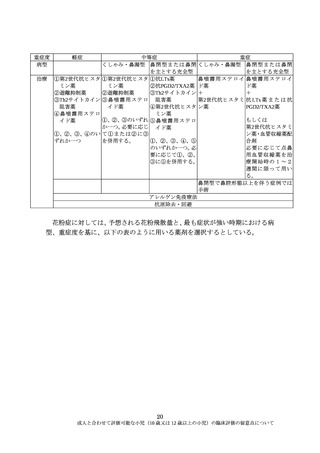
成人と同一、または成人の範囲内の用法・用量が想定される場合には、有効性
の薬剤評価においては成人も小児も同様と考えられ、12歳以上の小児など一定
の年齢層の小児を成人と同様に有効性、安全性を評価していくことは妥当であ
る。したがって、臨床評価においては、小児の部分集団解析は必須ではない
が、血中薬物動態も含めた小児の情報を取得すること、一定の症例数が確保さ
れた場合には部分集団解析を行うことは有益であり、成人で設定された試験の
対象に12歳以上の小児も含めるべきである。
ただし、個々の薬剤の開発にあたっては、忍容性を考慮した用法・用量設定
の必要性の有無など、成人と同一、または成人の用法・用量の範囲内とするこ
とについて科学的な説明が必要である。
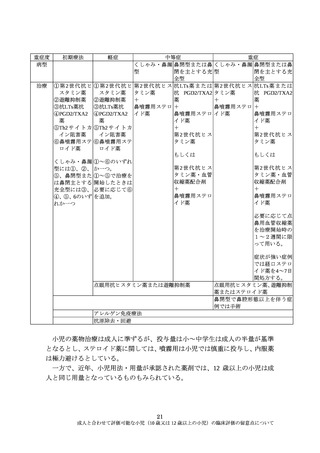
(7)市販後の情報収集
病態が成人と同様あるいは薬剤の臨床評価上同等と考えられる 12 歳以上の小
児については、成人の臨床試験に組み入れて評価することが妥当であるが、一般
的には、造血器悪性腫瘍については、その希少性から臨床試験への組入れ症例数
は少数になることが想定される。このような場合は、市販直後から、投与対象と
なる小児の年齢層に対する重点的な情報収集し、早い段階で得られた情報を医
療現場に提供するとともに、市販直後は対象施設などを限定して使用を開始し、
段階的に使用を拡大する等の方策も考慮すべきである。
また、造血器悪性腫瘍は致死的な疾患であり、常に治療成績の向上が求められ
る領域である。したがって、臨床試験に小児を組み入れることで、有効性・安全
性について一定の評価がなされて承認された場合でも、引き続きより良い用法・
用量の検討が必要な場合もある。
(8)その他の留意点
抗悪性腫瘍薬の開発では、一般的な第1相、第 2 相、第3相というステップを
重視した開発に限らず、第 3 相試験終了を待たずに第 2 相試験結果で承認申請
される場合もある。また、マスタープロトコル等の新たな開発手法も検討されて
いる。成人において用法・用量が確定していない段階での 12 歳以上の小児の組
入れについては、個々の開発計画や試験目的を踏まえ、個々の薬剤ごとにその妥
当性を説明することが必要である。
Reference:
1) 「小児悪性腫瘍における抗悪性腫瘍薬の臨床評価方法に関するガイダンス」
について 平成 27 年9月 30 日付け薬食審査発 0930 第 1 号
薬食品局審査管理課長通知
厚生労働省医
31
成人と合わせて評価可能な小児(10 歳又は 12 歳以上の小児)の臨床評価の留意点について
の薬剤評価においては成人も小児も同様と考えられ、12歳以上の小児など一定
の年齢層の小児を成人と同様に有効性、安全性を評価していくことは妥当であ
る。したがって、臨床評価においては、小児の部分集団解析は必須ではない
が、血中薬物動態も含めた小児の情報を取得すること、一定の症例数が確保さ
れた場合には部分集団解析を行うことは有益であり、成人で設定された試験の
対象に12歳以上の小児も含めるべきである。
ただし、個々の薬剤の開発にあたっては、忍容性を考慮した用法・用量設定
の必要性の有無など、成人と同一、または成人の用法・用量の範囲内とするこ
とについて科学的な説明が必要である。
(7)市販後の情報収集
病態が成人と同様あるいは薬剤の臨床評価上同等と考えられる 12 歳以上の小
児については、成人の臨床試験に組み入れて評価することが妥当であるが、一般
的には、造血器悪性腫瘍については、その希少性から臨床試験への組入れ症例数
は少数になることが想定される。このような場合は、市販直後から、投与対象と
なる小児の年齢層に対する重点的な情報収集し、早い段階で得られた情報を医
療現場に提供するとともに、市販直後は対象施設などを限定して使用を開始し、
段階的に使用を拡大する等の方策も考慮すべきである。
また、造血器悪性腫瘍は致死的な疾患であり、常に治療成績の向上が求められ
る領域である。したがって、臨床試験に小児を組み入れることで、有効性・安全
性について一定の評価がなされて承認された場合でも、引き続きより良い用法・
用量の検討が必要な場合もある。
(8)その他の留意点
抗悪性腫瘍薬の開発では、一般的な第1相、第 2 相、第3相というステップを
重視した開発に限らず、第 3 相試験終了を待たずに第 2 相試験結果で承認申請
される場合もある。また、マスタープロトコル等の新たな開発手法も検討されて
いる。成人において用法・用量が確定していない段階での 12 歳以上の小児の組
入れについては、個々の開発計画や試験目的を踏まえ、個々の薬剤ごとにその妥
当性を説明することが必要である。
Reference:
1) 「小児悪性腫瘍における抗悪性腫瘍薬の臨床評価方法に関するガイダンス」
について 平成 27 年9月 30 日付け薬食審査発 0930 第 1 号
薬食品局審査管理課長通知
厚生労働省医
31
成人と合わせて評価可能な小児(10 歳又は 12 歳以上の小児)の臨床評価の留意点について