よむ、つかう、まなぶ。
【資料4】モルヌピラビル(ラゲブリオカプセル200mg )の安全性について(医薬・生活衛生局の説明資料) (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
ータモニタリング委員会により本薬の有効性が示されたとの勧告がなされ、2021 年 10 月 2 日以降の新
規組入れは中止された。本項においては当該中間解析の結果を示す。
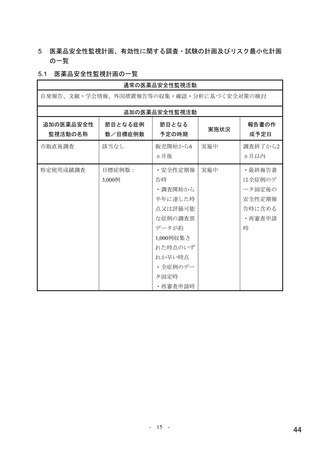
目標被験者数について、本試験開始時は主要評価項目である無作為化 29 日目までに理由を問わない
入院又は死亡が認められた被験者の割合について、本薬群とプラセボ群の期待群間差を 6%として、有
意水準片側 2.5%の下、検出力を 92%確保するために必要な例数として、1,150 例(各群 575 例)と設定
された。第Ⅱ相パートの結果が得られた後、プロトコル改訂第 2 版(2021 年 4 月 14 日)において、主
要評価項目の期待発現割合について、本薬群 6%及びプラセボ群 12%、期待群間差を 6%として、有意水
準片側 2.5%の下、検出力を 97%確保するために必要な例数として、1,550 例(各群 775 例)と再設定さ
れた。
無作為化された 775 例(本薬群 387 例、プラセボ群 388 例)のうち、治験薬が 1 回以上投与された 765
例(本薬群 386 例、プラセボ群 379 例)が安全性解析対象とされた。安全性解析対象集団のうち、治験
薬投与開始前に入院した 13 例を除く 762 例(本薬群 385 例、プラセボ群 377 例)が MITT 集団とされ、
有効性解析対象集団とされた。なお、中間解析に日本人は含まれていない。
無作為化 29 日目までの試験中止例22)は 38 例(本薬群 17 例、プラセボ群 21 例)であり、その内訳は、
死亡 8 例(プラセボ群 8 例)、追跡不能 8 例(本薬群 5 例、プラセボ群 3 例)、被験者の申し出 21 例
(本薬群 12 例、プラセボ群 9 例)、その他 1 例(プラセボ群 1 例)であった。
有効性について、主要評価項目である MITT 集団における無作為化 29 日目までに理由を問わない入
院23)又は死亡(以下、「イベント」)が認められた被験者の割合は表 8 のとおりであり、本薬群とプラ
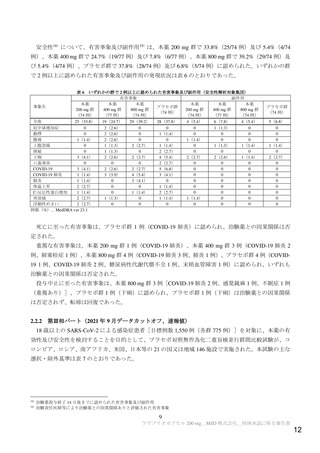
セボ群との比較において統計的に有意な差が認められた。また、主要評価項目のイベント発現までの累
積発現割合の推移についての Kaplan-Meier 曲線は図 2 のとおりであった。なお、イベント発現例のうち、
理由を問わない入院は本薬群 28 例及びプラセボ群 52 例、理由を問わない死亡は本薬群 0 例及びプラセ
ボ群 8 例、不明は本薬群 0 例及びプラセボ群 1 例であった(入院後に死亡した被験者は重複してカウン
ト)24)。
表8
無作為化 29 日目までに理由を問わない入院又は死亡が認められた被験者の割合(MITT 集団)
本薬群
プラセボ群
イベント発現割合
7.3%(28/385 例)
14.1%(53/377 例)
プラセボ群との差[95%信頼区間]a)
-6.8[-11.3, -2.4]
0.0012
片側 p 値 a)b)
無作為化 29 日目の生存状況が不明な場合はイベントとし、本試験を早期中止し無作為化 29 日目の生存状況が生存と判明して
いるが、入院状況が不明である場合は非イベントとされた。
a)症状発現から無作為割付け日までの期間(3 日間以下、3 日間超)を層別因子とした層別 Miettinen and Nurminen 法(Stat. Med.
1985; 4: 213-26)
b)有意水準片側 0.0092、試験全体の有意水準は片側 2.5%とされ、中間解析による仮説検定の多重性の調整方法として Gamma
family 型(γ=-1)の消費関数が用いられた。
治験薬が 1 回以上投与された被験者における試験中止例
病院又は同様の急性期治療施設において 24 時間以上の急性期治療を行った場合。
24)
治験責任医師等が SARS-CoV-2 による感染症に関連のある入院又は死亡であると判断したのは、本薬群 6.5%(25/385 例)及びプラセ
ボ群 13.3%(50/377 例)であった。
22)
23)
11
ラゲブリオカプセル 200 mg_MSD 株式会社_特例承認に係る報告書
14
規組入れは中止された。本項においては当該中間解析の結果を示す。
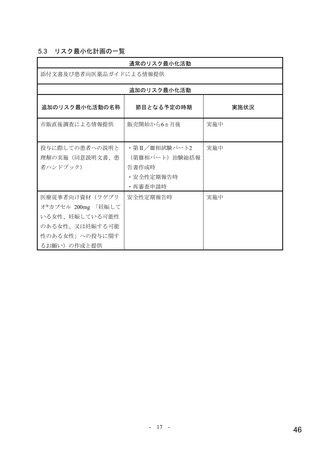
目標被験者数について、本試験開始時は主要評価項目である無作為化 29 日目までに理由を問わない
入院又は死亡が認められた被験者の割合について、本薬群とプラセボ群の期待群間差を 6%として、有
意水準片側 2.5%の下、検出力を 92%確保するために必要な例数として、1,150 例(各群 575 例)と設定
された。第Ⅱ相パートの結果が得られた後、プロトコル改訂第 2 版(2021 年 4 月 14 日)において、主
要評価項目の期待発現割合について、本薬群 6%及びプラセボ群 12%、期待群間差を 6%として、有意水
準片側 2.5%の下、検出力を 97%確保するために必要な例数として、1,550 例(各群 775 例)と再設定さ
れた。
無作為化された 775 例(本薬群 387 例、プラセボ群 388 例)のうち、治験薬が 1 回以上投与された 765
例(本薬群 386 例、プラセボ群 379 例)が安全性解析対象とされた。安全性解析対象集団のうち、治験
薬投与開始前に入院した 13 例を除く 762 例(本薬群 385 例、プラセボ群 377 例)が MITT 集団とされ、
有効性解析対象集団とされた。なお、中間解析に日本人は含まれていない。
無作為化 29 日目までの試験中止例22)は 38 例(本薬群 17 例、プラセボ群 21 例)であり、その内訳は、
死亡 8 例(プラセボ群 8 例)、追跡不能 8 例(本薬群 5 例、プラセボ群 3 例)、被験者の申し出 21 例
(本薬群 12 例、プラセボ群 9 例)、その他 1 例(プラセボ群 1 例)であった。
有効性について、主要評価項目である MITT 集団における無作為化 29 日目までに理由を問わない入
院23)又は死亡(以下、「イベント」)が認められた被験者の割合は表 8 のとおりであり、本薬群とプラ
セボ群との比較において統計的に有意な差が認められた。また、主要評価項目のイベント発現までの累
積発現割合の推移についての Kaplan-Meier 曲線は図 2 のとおりであった。なお、イベント発現例のうち、
理由を問わない入院は本薬群 28 例及びプラセボ群 52 例、理由を問わない死亡は本薬群 0 例及びプラセ
ボ群 8 例、不明は本薬群 0 例及びプラセボ群 1 例であった(入院後に死亡した被験者は重複してカウン
ト)24)。
表8
無作為化 29 日目までに理由を問わない入院又は死亡が認められた被験者の割合(MITT 集団)
本薬群
プラセボ群
イベント発現割合
7.3%(28/385 例)
14.1%(53/377 例)
プラセボ群との差[95%信頼区間]a)
-6.8[-11.3, -2.4]
0.0012
片側 p 値 a)b)
無作為化 29 日目の生存状況が不明な場合はイベントとし、本試験を早期中止し無作為化 29 日目の生存状況が生存と判明して
いるが、入院状況が不明である場合は非イベントとされた。
a)症状発現から無作為割付け日までの期間(3 日間以下、3 日間超)を層別因子とした層別 Miettinen and Nurminen 法(Stat. Med.
1985; 4: 213-26)
b)有意水準片側 0.0092、試験全体の有意水準は片側 2.5%とされ、中間解析による仮説検定の多重性の調整方法として Gamma
family 型(γ=-1)の消費関数が用いられた。
治験薬が 1 回以上投与された被験者における試験中止例
病院又は同様の急性期治療施設において 24 時間以上の急性期治療を行った場合。
24)
治験責任医師等が SARS-CoV-2 による感染症に関連のある入院又は死亡であると判断したのは、本薬群 6.5%(25/385 例)及びプラセ
ボ群 13.3%(50/377 例)であった。
22)
23)
11
ラゲブリオカプセル 200 mg_MSD 株式会社_特例承認に係る報告書
14