よむ、つかう、まなぶ。
【資料4】モルヌピラビル(ラゲブリオカプセル200mg )の安全性について(医薬・生活衛生局の説明資料) (42 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
4
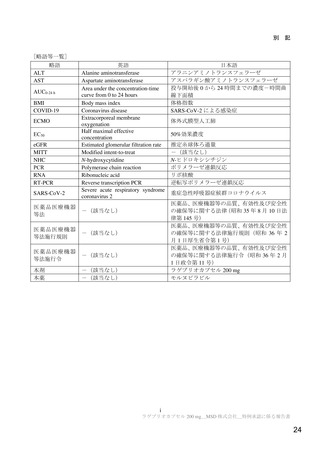
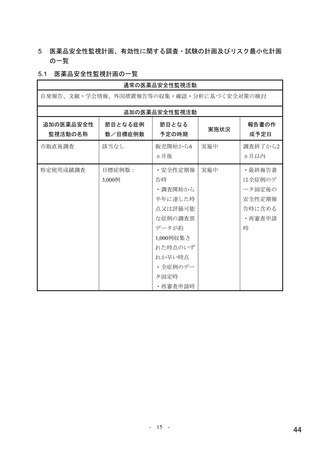
リスク最小化計画の概要
通常のリスク最小化活動
通常のリスク最小化活動の概要:
添付文書及び患者向医薬品ガイドによる情報提供
追加のリスク最小化活動
市販直後調査による情報提供
実施期間:販売開始から6ヵ月間
評価、報告の予定時期:調査終了から2ヵ月以内
投与に際しての患者への説明と理解の実施(同意説明文書、患者ハンドブック)
【目的】
患者又は代諾者に対して、本剤に関する以下の事項について十分に説明し、同意を
取得した後に本剤を投与することを目的として情報提供する。
・本剤の特例承認の位置づけ、本剤の投与方法、有効性及び安全性情報
・本剤を投与する際に注意すべき事項等の情報
【具体的な方法】
以下の資材を医療従事者向け企業ホームページに掲載するとともに本剤納入先に提
供し、資材の活用を依頼する。
・ラゲブリオ®カプセル 200mg による治療に係る同意説明文書(雛形)
・ラゲブリオ®カプセル 200mg による治療を受ける患者さん・そのご家族の方へ
【節目となる予定の時期、実施した結果に基づき採択される可能性がある更なる処
置】
第Ⅱ/Ⅲ相試験パート2(第Ⅲ相パート)治験総括報告書作成時、安全性定期報告
時及び再審査時に確認する。本結果に基づき、リスク最小化策の更なる強化が必要
と判断された場合には、資材の改訂、配布方法等の実施方法の変更、追加の資材作
成等を検討する。
【実施状況及び得られた結果の評価、又は総合機構への報告を行う節目となる予定の
時期及び根拠】
・第Ⅱ/Ⅲ相試験パート2(第Ⅲ相パート)治験総括報告書作成時
・安全性定期報告時
・再審査申請時
- 13
-
42
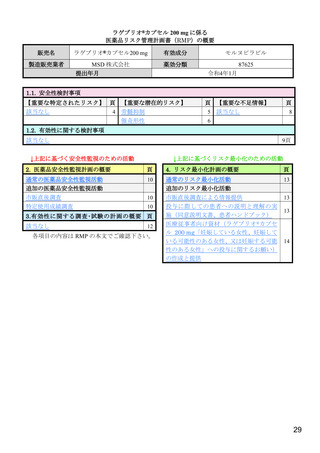
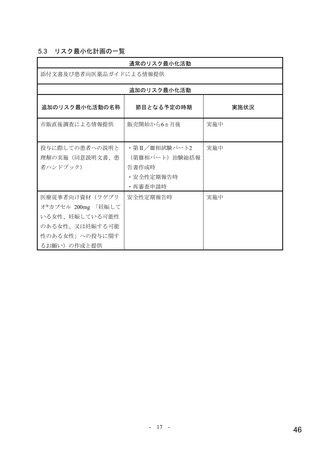
リスク最小化計画の概要
通常のリスク最小化活動
通常のリスク最小化活動の概要:
添付文書及び患者向医薬品ガイドによる情報提供
追加のリスク最小化活動
市販直後調査による情報提供
実施期間:販売開始から6ヵ月間
評価、報告の予定時期:調査終了から2ヵ月以内
投与に際しての患者への説明と理解の実施(同意説明文書、患者ハンドブック)
【目的】
患者又は代諾者に対して、本剤に関する以下の事項について十分に説明し、同意を
取得した後に本剤を投与することを目的として情報提供する。
・本剤の特例承認の位置づけ、本剤の投与方法、有効性及び安全性情報
・本剤を投与する際に注意すべき事項等の情報
【具体的な方法】
以下の資材を医療従事者向け企業ホームページに掲載するとともに本剤納入先に提
供し、資材の活用を依頼する。
・ラゲブリオ®カプセル 200mg による治療に係る同意説明文書(雛形)
・ラゲブリオ®カプセル 200mg による治療を受ける患者さん・そのご家族の方へ
【節目となる予定の時期、実施した結果に基づき採択される可能性がある更なる処
置】
第Ⅱ/Ⅲ相試験パート2(第Ⅲ相パート)治験総括報告書作成時、安全性定期報告
時及び再審査時に確認する。本結果に基づき、リスク最小化策の更なる強化が必要
と判断された場合には、資材の改訂、配布方法等の実施方法の変更、追加の資材作
成等を検討する。
【実施状況及び得られた結果の評価、又は総合機構への報告を行う節目となる予定の
時期及び根拠】
・第Ⅱ/Ⅲ相試験パート2(第Ⅲ相パート)治験総括報告書作成時
・安全性定期報告時
・再審査申請時
- 13
-
42