よむ、つかう、まなぶ。
【資料4】モルヌピラビル(ラゲブリオカプセル200mg )の安全性について(医薬・生活衛生局の説明資料) (34 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
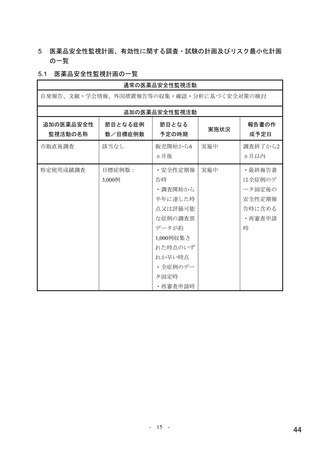
重要な潜在的リスク
骨髄抑制
重要な潜在的リスクとした理由:
イヌにモルヌピラビル(MOV)を反復投与した実験において、MOV の主要代謝物で
ある N-ヒドロキシシチジン(NHC)の曝露量がヒトに MOV 800 mg を12時間間隔で
投与したときの臨床曝露量の0.4倍以上に相当する用量で、回復性のある骨髄抑制
(すべての造血系細胞に影響)が認められた。MOV を7日間投与した際に循環血の
血球系細胞数及び血小板数に軽度の減少がみられ、14日間の投与で循環血により重度
の変化がみられた。同様の変化はマウス、ラット、ウサギ及びサルでは認められてい
ない。
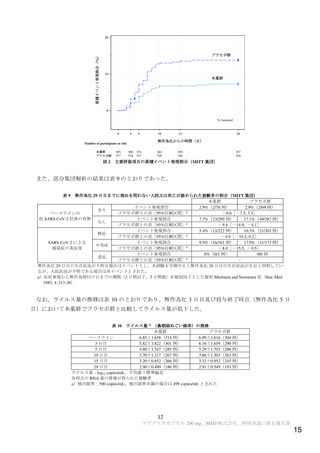
健康被験者を対象とした第Ⅰ相試験(004試験)及び COVID-19患者を対象とした第
Ⅱ/Ⅲ相試験(001試験パート1、002試験パート1及び2)、並びに第Ⅱ相試験(006試
験)において、骨髄抑制に関連する有害事象の発現はまれで、発現割合は本剤群とプ
ラセボ群で同程度であった。血液学的パラメータの変化の程度も本剤群とプラセボ群
で同程度であり、好中球数及び血小板数にグレード3又はグレード4の変化は認められ
なかった。
しかしながら、COVID-19患者を対象とした臨床試験において、ヘモグロビン値のグ
レード3の変化が、001試験パート1では、本剤800 mg 群で3例(6.1%)
、プラセボ群で
1例(2.1%)
、002試験のパート2では、本剤800 mg 群で1例(0.3%)
、プラセボ群で3例
(0.9%)に認められた。002試験パート1及び006試験では、本剤800 mg 群及びプラセ
ボ群のいずれにも変化は報告されなかった。また、COVID-19患者を対象とした臨床
試験において、骨髄抑制に関連する有害事象が以下のとおり報告された。002試験パ
ート2では、本剤800 mg 群で好中球減少症及び血小板数減少各1例(0.3%)
、プラセボ
群で血小板数減少2例(0.5%)、免疫性血小板減少症、鉄欠乏性貧血及び白血球減少
症各1例(0.3%)が認められた。001試験パート1では、本剤800 mg 群で血小板数減少
、貧血、二系統血球減少症及び好中球数減少各1例(1.4%)
、プラセボ群
2例(2.8%)
で血小板減少症及び血小板数減少各1例(1.3%)が認められた。006試験では、本剤
800 mg 群で貧血1例(1.8%)が認められたが、プラセボ群では認められなかった。な
お、002試験パート1では、本剤群及びプラセボ群のいずれにも、該当する有害事象は
認められなかった。
以上より、骨髄抑制を重要な潜在的リスクとした。
- 5 -
34
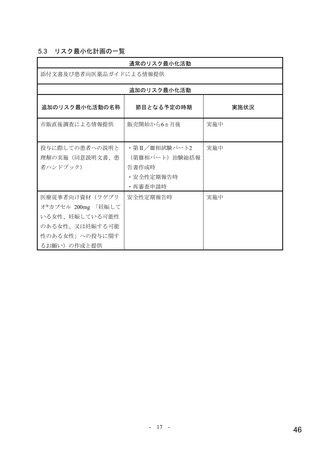
骨髄抑制
重要な潜在的リスクとした理由:
イヌにモルヌピラビル(MOV)を反復投与した実験において、MOV の主要代謝物で
ある N-ヒドロキシシチジン(NHC)の曝露量がヒトに MOV 800 mg を12時間間隔で
投与したときの臨床曝露量の0.4倍以上に相当する用量で、回復性のある骨髄抑制
(すべての造血系細胞に影響)が認められた。MOV を7日間投与した際に循環血の
血球系細胞数及び血小板数に軽度の減少がみられ、14日間の投与で循環血により重度
の変化がみられた。同様の変化はマウス、ラット、ウサギ及びサルでは認められてい
ない。
健康被験者を対象とした第Ⅰ相試験(004試験)及び COVID-19患者を対象とした第
Ⅱ/Ⅲ相試験(001試験パート1、002試験パート1及び2)、並びに第Ⅱ相試験(006試
験)において、骨髄抑制に関連する有害事象の発現はまれで、発現割合は本剤群とプ
ラセボ群で同程度であった。血液学的パラメータの変化の程度も本剤群とプラセボ群
で同程度であり、好中球数及び血小板数にグレード3又はグレード4の変化は認められ
なかった。
しかしながら、COVID-19患者を対象とした臨床試験において、ヘモグロビン値のグ
レード3の変化が、001試験パート1では、本剤800 mg 群で3例(6.1%)
、プラセボ群で
1例(2.1%)
、002試験のパート2では、本剤800 mg 群で1例(0.3%)
、プラセボ群で3例
(0.9%)に認められた。002試験パート1及び006試験では、本剤800 mg 群及びプラセ
ボ群のいずれにも変化は報告されなかった。また、COVID-19患者を対象とした臨床
試験において、骨髄抑制に関連する有害事象が以下のとおり報告された。002試験パ
ート2では、本剤800 mg 群で好中球減少症及び血小板数減少各1例(0.3%)
、プラセボ
群で血小板数減少2例(0.5%)、免疫性血小板減少症、鉄欠乏性貧血及び白血球減少
症各1例(0.3%)が認められた。001試験パート1では、本剤800 mg 群で血小板数減少
、貧血、二系統血球減少症及び好中球数減少各1例(1.4%)
、プラセボ群
2例(2.8%)
で血小板減少症及び血小板数減少各1例(1.3%)が認められた。006試験では、本剤
800 mg 群で貧血1例(1.8%)が認められたが、プラセボ群では認められなかった。な
お、002試験パート1では、本剤群及びプラセボ群のいずれにも、該当する有害事象は
認められなかった。
以上より、骨髄抑制を重要な潜在的リスクとした。
- 5 -
34