よむ、つかう、まなぶ。
【資料4】モルヌピラビル(ラゲブリオカプセル200mg )の安全性について(医薬・生活衛生局の説明資料) (39 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2
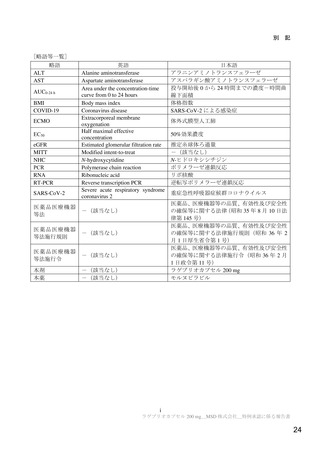
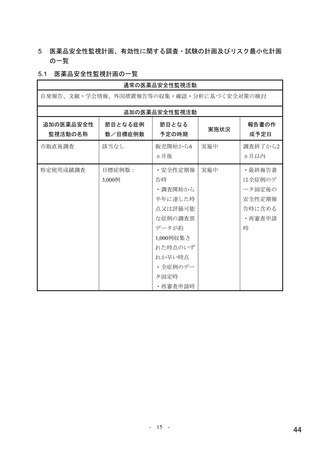
医薬品安全性監視計画の概要
通常の医薬品安全性監視活動
通常の医薬品安全性監視活動の概要:
自発報告、文献・学会情報、外国措置報告等の収集・確認・分析に基づく安全対策の検討
追加の医薬品安全性監視活動
市販直後調査
実施期間:販売開始から6ヵ月間
評価、報告の予定時期:調査終了から2ヵ月以内
特定使用成績調査
【安全性検討事項】
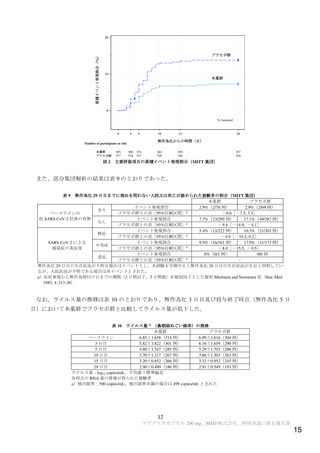
骨髄抑制
【目的】
本調査では日常の診療下においてラゲブリオ®カプセル 200mg(以下、本剤)を日
本人患者へ投与時の安全性を可能な限り承認後早期に確認し、検討する。なお、有
効性についても副次的に確認する。
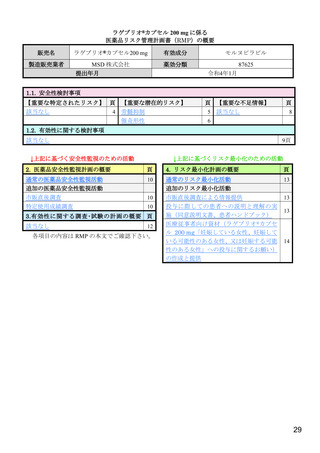
【実施計画】
実施期間:調査開始日から3年
登録期間:調査開始日から2年
目標症例数:3,000例(2年間を目処に目標症例数に達する見込みがない場合は、総
合機構に相談する)
実施方法:連続登録方式
【実施計画の根拠】
第Ⅱ/Ⅲ相試験(002試験)のパート2(第Ⅲ相パート)の中間解析における本剤の
副作用発現割合は12.4%であった。仮に本邦市販後での副作用発現割合を同等と仮定
した場合、2,838例の組入れにより90%の確率で330例以上に副作用が検出されるた
め、解析対象集団からの除外症例を考慮した目標症例数は3,000例とする。また、
0.1%以上の頻度で発現する未知の副作用を95%の信頼度で少なくとも1例検出するた
めには3,000症例が必要であることから、安全性解析対象症例として3,000例と設定し
た。
【節目となる予定の時期及びその根拠】
・安全性定期報告時:安全性情報について包括的な検討を行うため。
・調査開始から半年に達した時点又は評価可能な症例の調査票データが約1,000例収
集された時点のいずれか早い時点:可能な限り早期に安全性情報を検討し、総合機
- 10
-
39
医薬品安全性監視計画の概要
通常の医薬品安全性監視活動
通常の医薬品安全性監視活動の概要:
自発報告、文献・学会情報、外国措置報告等の収集・確認・分析に基づく安全対策の検討
追加の医薬品安全性監視活動
市販直後調査
実施期間:販売開始から6ヵ月間
評価、報告の予定時期:調査終了から2ヵ月以内
特定使用成績調査
【安全性検討事項】
骨髄抑制
【目的】
本調査では日常の診療下においてラゲブリオ®カプセル 200mg(以下、本剤)を日
本人患者へ投与時の安全性を可能な限り承認後早期に確認し、検討する。なお、有
効性についても副次的に確認する。
【実施計画】
実施期間:調査開始日から3年
登録期間:調査開始日から2年
目標症例数:3,000例(2年間を目処に目標症例数に達する見込みがない場合は、総
合機構に相談する)
実施方法:連続登録方式
【実施計画の根拠】
第Ⅱ/Ⅲ相試験(002試験)のパート2(第Ⅲ相パート)の中間解析における本剤の
副作用発現割合は12.4%であった。仮に本邦市販後での副作用発現割合を同等と仮定
した場合、2,838例の組入れにより90%の確率で330例以上に副作用が検出されるた
め、解析対象集団からの除外症例を考慮した目標症例数は3,000例とする。また、
0.1%以上の頻度で発現する未知の副作用を95%の信頼度で少なくとも1例検出するた
めには3,000症例が必要であることから、安全性解析対象症例として3,000例と設定し
た。
【節目となる予定の時期及びその根拠】
・安全性定期報告時:安全性情報について包括的な検討を行うため。
・調査開始から半年に達した時点又は評価可能な症例の調査票データが約1,000例収
集された時点のいずれか早い時点:可能な限り早期に安全性情報を検討し、総合機
- 10
-
39