よむ、つかう、まなぶ。
【資料4】モルヌピラビル(ラゲブリオカプセル200mg )の安全性について(医薬・生活衛生局の説明資料) (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
重篤な有害事象は、本薬群 28 例[COVID-19 22 例、COVID-19 肺炎 15 例、呼吸不全 4 例、細菌性肺
炎 2 例、肛門膿瘍、扁桃周囲炎、肺炎、真菌性肺炎、ブドウ球菌性肺炎、糖尿病性ケトアシドーシス、
誤嚥性肺炎及びショック各 1 例(重複あり)]、プラセボ群 53 例[COVID-19 45 例、COVID-19 肺炎 28
例、呼吸不全 8 例、肺炎、細菌性肺炎及び急性呼吸不全各 2 例、急性心筋梗塞、心房粗動、ヘモフィル
ス性肺炎、敗血症性ショック、ブドウ球菌性菌血症、糖尿病性ケトアシドーシス、糖尿病性代謝代償不
全、2 型糖尿病、肺転移、急性腎障害、咳嗽、呼吸困難、しゃっくり、低酸素症、気縦隔症、肺塞栓症、
肺高血圧症及び呼吸窮迫各 1 例(重複あり)]に認められ、いずれも治験薬との因果関係は否定された。
投与中止に至った有害事象は、本薬群 5 例[悪心及び嘔吐各 2 例、霧視、疲労、扁桃周囲炎、扁桃炎、
浮動性めまい及び頭痛各 1 例(重複あり)]、プラセボ群 13 例[COVID-19 7 例、COVID-19 肺炎 3 例、
上腹部痛及び下痢各 2 例、胸部不快感、糖尿病性代謝代償不全、筋肉痛、不眠症及びしゃっくり各 1 例
(重複あり)]に認められ、本薬群 3 例[霧視、悪心、嘔吐、疲労、浮動性めまい及び頭痛各 1 例(重
複あり)]及びプラセボ群 3 例[上腹部痛及び下痢各 2 例、胸部不快感及び不眠症各 1 例(重複あり)]
は治験薬との因果関係は否定されず、転帰は回復又は軽快であった。
中間解析の後、無作為化されたすべての被験者(1,433 例)の無作為化 29 日目までの有効性及び安全
性のデータの速報値が公表され、結果は以下のとおりであった28)29)。
有効性について、主要評価項目である無作為化 29 日目までに理由を問わない入院又は死亡(以下、
「イベント」)が認められた被験者の割合は、表 12 のとおりであった。なお、イベント発現例のうち、
理由を問わない入院は本薬群 48 例及びプラセボ群 67 例、理由を問わない死亡は本薬群 1 例及びプラセ
ボ群 9 例、不明は本薬群 0 例及びプラセボ群 1 例であった(入院後に死亡した被験者は重複してカウン
ト)30)。
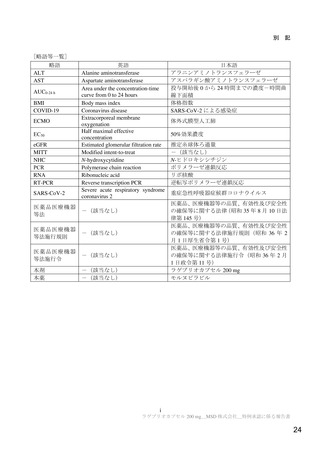
表 12
無作為化 29 日目までに理由を問わない入院又は死亡が認められた被験者の割合(MITT 集団)
本薬群
プラセボ群
イベント発現割合
6.8%(48/709 例)
9.7%(68/699 例)
プラセボ群との差[95%信頼区間]a)
-3.0[-5.9, -0.1]
0.0218
片側 p 値 a)
無作為化 29 日目の生存状況が不明な場合はイベントとされた。
a)症状発現から無作為割付け日までの期間(3 日間以下、3 日間超)を層別因子とした層別 Miettinen and Nurminen 法(Stat. Med.
1985; 4: 213-26)
安全性 26)について、有害事象及び副作用 27)は、本薬群で 30.4%(216/710 例)及び 8.0%(57/710 例)、
プラセボ群で 33.0%(231/701 例)及び 8.4%(59/701 例)に認められた。いずれかの群で 2%以上に認め
られた有害事象は下痢[本薬群 2.3%(16/710 例)、プラセボ群 3.0%(21/701 例)]、COVID-19[本薬
群 7.9%(56/710 例)、プラセボ群 9.8%(69/701 例)]、COVID-19 肺炎[本薬群 6.3%(45/710 例)、
プラセボ群 9.6%(67/701 例)]、細菌性肺炎[本薬群 2.0%(14/710 例)、プラセボ群 1.6%(11/701 例)]
であった。いずれかの群で 1%以上に認められた副作用は下痢[本薬群 1.7%(12/710 例)、プラセボ群
2.1%(15/701 例)]、悪心[本薬群 1.4%(10/710 例)、プラセボ群 0.7%(5/701 例)]及び浮動性めま
28 )
米 国 FDA Antimicrobial Drugs Advisory Committee Meeting November 30, 2021 資 料 : https://www.fda.gov/media/154419/download 、
https://www.fda.gov/media/154422/download(最終確認日:2021 年 12 月 6 日)
29)
事前に計画された中間解析において早期有効中止となったことから、本試験の成功の可否を判定する上での主たる結果は中間解析の
主要評価項目の結果となるが、無作為化されたすべての被験者に関する解析の結果は中間解析よりも多くの被験者の結果を含むこと
から、当該結果も本薬の有効性を理解する上で参考になり得る。
30)
治験責任医師等が SARS-CoV-2 による感染症に関連のある入院又は死亡であると判断したのは、本薬群 6.3%(45/709 例)及びプラセ
ボ群 9.2%(64/699 例)であった。
15
ラゲブリオカプセル 200 mg_MSD 株式会社_特例承認に係る報告書
18
炎 2 例、肛門膿瘍、扁桃周囲炎、肺炎、真菌性肺炎、ブドウ球菌性肺炎、糖尿病性ケトアシドーシス、
誤嚥性肺炎及びショック各 1 例(重複あり)]、プラセボ群 53 例[COVID-19 45 例、COVID-19 肺炎 28
例、呼吸不全 8 例、肺炎、細菌性肺炎及び急性呼吸不全各 2 例、急性心筋梗塞、心房粗動、ヘモフィル
ス性肺炎、敗血症性ショック、ブドウ球菌性菌血症、糖尿病性ケトアシドーシス、糖尿病性代謝代償不
全、2 型糖尿病、肺転移、急性腎障害、咳嗽、呼吸困難、しゃっくり、低酸素症、気縦隔症、肺塞栓症、
肺高血圧症及び呼吸窮迫各 1 例(重複あり)]に認められ、いずれも治験薬との因果関係は否定された。
投与中止に至った有害事象は、本薬群 5 例[悪心及び嘔吐各 2 例、霧視、疲労、扁桃周囲炎、扁桃炎、
浮動性めまい及び頭痛各 1 例(重複あり)]、プラセボ群 13 例[COVID-19 7 例、COVID-19 肺炎 3 例、
上腹部痛及び下痢各 2 例、胸部不快感、糖尿病性代謝代償不全、筋肉痛、不眠症及びしゃっくり各 1 例
(重複あり)]に認められ、本薬群 3 例[霧視、悪心、嘔吐、疲労、浮動性めまい及び頭痛各 1 例(重
複あり)]及びプラセボ群 3 例[上腹部痛及び下痢各 2 例、胸部不快感及び不眠症各 1 例(重複あり)]
は治験薬との因果関係は否定されず、転帰は回復又は軽快であった。
中間解析の後、無作為化されたすべての被験者(1,433 例)の無作為化 29 日目までの有効性及び安全
性のデータの速報値が公表され、結果は以下のとおりであった28)29)。
有効性について、主要評価項目である無作為化 29 日目までに理由を問わない入院又は死亡(以下、
「イベント」)が認められた被験者の割合は、表 12 のとおりであった。なお、イベント発現例のうち、
理由を問わない入院は本薬群 48 例及びプラセボ群 67 例、理由を問わない死亡は本薬群 1 例及びプラセ
ボ群 9 例、不明は本薬群 0 例及びプラセボ群 1 例であった(入院後に死亡した被験者は重複してカウン
ト)30)。
表 12
無作為化 29 日目までに理由を問わない入院又は死亡が認められた被験者の割合(MITT 集団)
本薬群
プラセボ群
イベント発現割合
6.8%(48/709 例)
9.7%(68/699 例)
プラセボ群との差[95%信頼区間]a)
-3.0[-5.9, -0.1]
0.0218
片側 p 値 a)
無作為化 29 日目の生存状況が不明な場合はイベントとされた。
a)症状発現から無作為割付け日までの期間(3 日間以下、3 日間超)を層別因子とした層別 Miettinen and Nurminen 法(Stat. Med.
1985; 4: 213-26)
安全性 26)について、有害事象及び副作用 27)は、本薬群で 30.4%(216/710 例)及び 8.0%(57/710 例)、
プラセボ群で 33.0%(231/701 例)及び 8.4%(59/701 例)に認められた。いずれかの群で 2%以上に認め
られた有害事象は下痢[本薬群 2.3%(16/710 例)、プラセボ群 3.0%(21/701 例)]、COVID-19[本薬
群 7.9%(56/710 例)、プラセボ群 9.8%(69/701 例)]、COVID-19 肺炎[本薬群 6.3%(45/710 例)、
プラセボ群 9.6%(67/701 例)]、細菌性肺炎[本薬群 2.0%(14/710 例)、プラセボ群 1.6%(11/701 例)]
であった。いずれかの群で 1%以上に認められた副作用は下痢[本薬群 1.7%(12/710 例)、プラセボ群
2.1%(15/701 例)]、悪心[本薬群 1.4%(10/710 例)、プラセボ群 0.7%(5/701 例)]及び浮動性めま
28 )
米 国 FDA Antimicrobial Drugs Advisory Committee Meeting November 30, 2021 資 料 : https://www.fda.gov/media/154419/download 、
https://www.fda.gov/media/154422/download(最終確認日:2021 年 12 月 6 日)
29)
事前に計画された中間解析において早期有効中止となったことから、本試験の成功の可否を判定する上での主たる結果は中間解析の
主要評価項目の結果となるが、無作為化されたすべての被験者に関する解析の結果は中間解析よりも多くの被験者の結果を含むこと
から、当該結果も本薬の有効性を理解する上で参考になり得る。
30)
治験責任医師等が SARS-CoV-2 による感染症に関連のある入院又は死亡であると判断したのは、本薬群 6.3%(45/709 例)及びプラセ
ボ群 9.2%(64/699 例)であった。
15
ラゲブリオカプセル 200 mg_MSD 株式会社_特例承認に係る報告書
18