よむ、つかう、まなぶ。
【資料4】モルヌピラビル(ラゲブリオカプセル200mg )の安全性について(医薬・生活衛生局の説明資料) (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
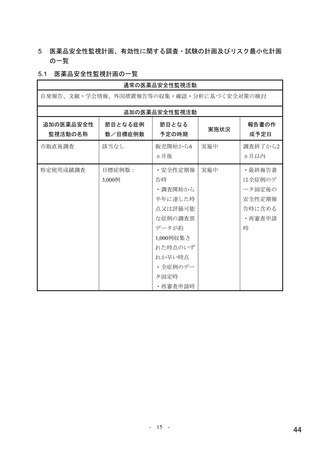
に相当する患者が組入れ可能とされていたことから、本剤はこれらの患者における治療選択肢の一つに
なると考える。なお、SARS-CoV-2 による感染症のために入院での治療を要する患者を対象に本薬 200 mg、
400 mg 及び 800 mg を 1 日 2 回 5 日間投与したときの有効性及び安全性を検討することを目的としたプ
ラセボ対照無作為化二重盲検並行群間比較試験(国際共同第Ⅱ/Ⅲ相試験、MK-4482-001 試験)において、
計画された中間解析の結果から明確な有効性が示されなかったことから、第Ⅲ相パートへの組入れは実
施されなかったことを踏まえると、本剤は重症度の高い患者に対する有効性が確立していない旨を添付
文書において注意喚起する必要があると考える。
また、国際共同第Ⅱ/Ⅲ相試験(MK-4482-002 試験)の第Ⅲ相パートは SARS-CoV-2 による感染症の重
症化リスク因子を有する患者が対象とされたが、本邦において、重症化リスク因子を有しない軽症~中
等症の患者における治療選択肢はないこと、当該試験において本剤の抗ウイルス薬としての有効性は示
されており、重症化リスク因子を有しない患者に対する有効性も類推可能と考えること、本剤は経口剤
であり軽症~中等症の患者への投与に適した剤形であること等を踏まえると、本剤の投与対象は重症化
リスク因子を有する患者が中心ではあるものの、高熱や呼吸器症状等の相当の症状を呈し重症化のおそ
れがある場合等、本剤の投与が必要と考えられる患者に対して投与可能としておくことは有用と考える。
4.
総合評価
本申請に際し提出された資料を踏まえ、本剤の SARS-CoV-2 による感染症に対する有効性は期待でき、
安全性については、得られた情報を踏まえて適切に注意喚起を行うことで管理可能と考える。ただし、
本申請に際し提出が猶予された資料を踏まえ、改めて本剤の品質、有効性及び安全性について検討する
必要がある。
以上を踏まえ、本剤を特例承認する場合の効能・効果、用法・用量及び承認条件等は、以下のように
設定することが適当と考えられる。本品目は新有効成分含有医薬品であることから再審査期間は 8 年、
生物由来製品及び特定生物由来製品のいずれにも該当せず、原体及び製剤はいずれも劇薬に該当すると
判断する。
[効能・効果]
SARS-CoV-2 による感染症
[用法・用量]
通常、18 歳以上の患者には、モルヌピラビルとして 1 回 800 mg を 1 日 2 回、5 日間経口投与する。
[承認条件等]
1.
本剤は、承認に当たり、医薬品医療機器等法第 14 条の 3 第 2 項の規定に基づき、医薬品医療機器等
法施行令第 28 条第 3 項各号に掲げる以下の義務を課すこととしたこと。
(1) 第 1 号関係
本剤は、承認時において一部の試験成績は評価されていないことから、追加の臨床試験の成績
がとりまとめられ次第、速やかに報告すること。
(2) 第 2 号関係
19
ラゲブリオカプセル 200 mg_MSD 株式会社_特例承認に係る報告書
22
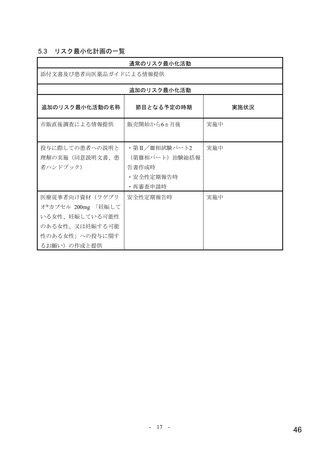
なると考える。なお、SARS-CoV-2 による感染症のために入院での治療を要する患者を対象に本薬 200 mg、
400 mg 及び 800 mg を 1 日 2 回 5 日間投与したときの有効性及び安全性を検討することを目的としたプ
ラセボ対照無作為化二重盲検並行群間比較試験(国際共同第Ⅱ/Ⅲ相試験、MK-4482-001 試験)において、
計画された中間解析の結果から明確な有効性が示されなかったことから、第Ⅲ相パートへの組入れは実
施されなかったことを踏まえると、本剤は重症度の高い患者に対する有効性が確立していない旨を添付
文書において注意喚起する必要があると考える。
また、国際共同第Ⅱ/Ⅲ相試験(MK-4482-002 試験)の第Ⅲ相パートは SARS-CoV-2 による感染症の重
症化リスク因子を有する患者が対象とされたが、本邦において、重症化リスク因子を有しない軽症~中
等症の患者における治療選択肢はないこと、当該試験において本剤の抗ウイルス薬としての有効性は示
されており、重症化リスク因子を有しない患者に対する有効性も類推可能と考えること、本剤は経口剤
であり軽症~中等症の患者への投与に適した剤形であること等を踏まえると、本剤の投与対象は重症化
リスク因子を有する患者が中心ではあるものの、高熱や呼吸器症状等の相当の症状を呈し重症化のおそ
れがある場合等、本剤の投与が必要と考えられる患者に対して投与可能としておくことは有用と考える。
4.
総合評価
本申請に際し提出された資料を踏まえ、本剤の SARS-CoV-2 による感染症に対する有効性は期待でき、
安全性については、得られた情報を踏まえて適切に注意喚起を行うことで管理可能と考える。ただし、
本申請に際し提出が猶予された資料を踏まえ、改めて本剤の品質、有効性及び安全性について検討する
必要がある。
以上を踏まえ、本剤を特例承認する場合の効能・効果、用法・用量及び承認条件等は、以下のように
設定することが適当と考えられる。本品目は新有効成分含有医薬品であることから再審査期間は 8 年、
生物由来製品及び特定生物由来製品のいずれにも該当せず、原体及び製剤はいずれも劇薬に該当すると
判断する。
[効能・効果]
SARS-CoV-2 による感染症
[用法・用量]
通常、18 歳以上の患者には、モルヌピラビルとして 1 回 800 mg を 1 日 2 回、5 日間経口投与する。
[承認条件等]
1.
本剤は、承認に当たり、医薬品医療機器等法第 14 条の 3 第 2 項の規定に基づき、医薬品医療機器等
法施行令第 28 条第 3 項各号に掲げる以下の義務を課すこととしたこと。
(1) 第 1 号関係
本剤は、承認時において一部の試験成績は評価されていないことから、追加の臨床試験の成績
がとりまとめられ次第、速やかに報告すること。
(2) 第 2 号関係
19
ラゲブリオカプセル 200 mg_MSD 株式会社_特例承認に係る報告書
22