よむ、つかう、まなぶ。
03 資料1-1 帯状疱疹ワクチンファクトシート (42 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40826.html |
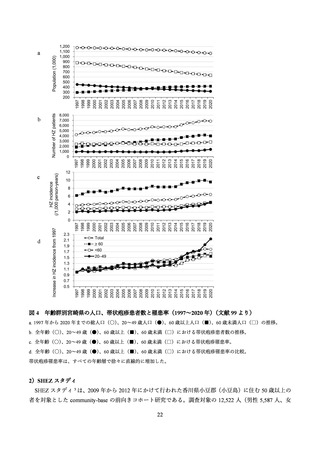
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 予防接種基本方針部会 ワクチン評価に関する小委員会(第26回 6/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
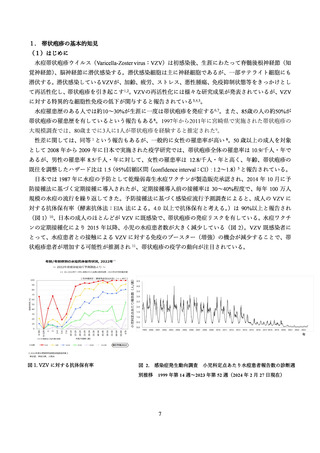
37.8%で報告された。多くは軽度から中等度であったがワクチン群の 17.0%、プラセボ群の 3.2%で日常生
活に支障を来たすグレード 3 の症状が報告された。これらの症状の多くは、ワクチン接種群の 81.5%(グ
レード 3 は 9.5%)とプラセボ群の 11.9%(グレード 3 は 0.4%)に発現した特定の注射部位の反応及び、
ワクチン接種群の 66.1%(グレード 3 は 11.4%)とプラセボ群の 29.5%(グレード 3 は 2.4%)に発現した
全身反応であった。疼痛は接種部位反応では最も多く、ワクチン群の 79.1%、プラセボ群の 11.2%で報告
された。筋肉痛は全身反応で最も多く、ワクチン群の 46.3%、プラセボ群の 12.1%で報告された。反応は
一過性であり、特定の有害事象では持続期間の中央値は 1~3 日間であった。グレード 3 の反応における
持続期間の中央値は、すべての全身反応と疼痛では 1 日間、発赤と腫脹は 2 日間であった。接種回数ご
との頻度は同程度であったが、グレード 3 の特定の全身反応は、初回接種(5.9%;95%CI: 5.2~6.6)と比
較して 2 回目接種後(8.5%;95%CI: 7.7~9.4)の方が頻度は高かった。接種 30 日以内に 231 件の重篤な
有害事象が報告され(ワクチン群;103 件、プラセボ群;128 件)
、全参加者では 7,698 例中 87 例(1.1%)、
7,713 例中 97 例(1.3%)であった。
これらの事象のうち、治験責任者が接種と関連すると判断した重篤な有害事象は 4 例(ワクチン群 1
例、プラセボ群 3 例)であり、失神を伴う低血圧、単神経炎、感覚神経障害、筋骨格系の胸痛であった。
平均追跡期間の 3.5 年後までの重篤な有害事象は、ワクチン群 689 例(9.0%)、プラセボ群 686 例(8.9%)
と同程度であり、頻度が高い事象は心筋梗塞と心不全であった。ワクチン群 78 例(1.0%)とプラセボ群
97 例
(1.3%)では、
免疫介在疾患の総数や種類は同様であった。死亡は 341 例でワクチン群 167 例
(2.2%)、
プラセボ群 174 例(2.3%)であった。
表 13. プラセボ群とワクチン群における有害事象
有害事象
ワクチン群
プラセボ群
%(95% CI)
参加人数
安全性評価サブグループ
4,460
%(95% CI)
参加人数
4,466
接種 30 日以内
有害事象報告(特定*のもの以外)
1308
29.3 (28.0-30.7)
1,226
27.5 (26.1-28.8)
上記のうち Grade3
208
4.7 (4.1-5.3)
151
3.4 (2.9-4.0)
3,765
84.4 (83.3–85.5)
1,689
37.8 (36.4–39.3)
上記のうち Grade3 の有害事象
760
17.0 (15.9–18.2)
145
3.2 (2.7–3.8)
上記のうち Grade3 の有害事象(接種に関連)
694
15.6 (14.5–16.7)
83
1.9 (1.5–2.3)
特定の有害事象(接種部位)*
3,571/4,382
81.5 (80.3–82.6)
522/4,377
11.9 (11.0–12.9)
疼痛*
3,464/4,382
79.1 (77.8–80.2)
490/4,377
11.2 (10.3–12.2)
発赤*
1,664/4,382
38.0 (36.5–39.4)
59/4,377
1.3 (1.0–1.7)
腫脹*
1,153/4,382
26.3 (25.0–27.6)
46/4,377
1.1 (0.8–1.4)
417/4,382
9.5 (8.7–10.4)
16/4,377
0.4 (0.2–0.6)
接種 7 日以内
全ての有害事象
Grade3 の特定の有害事象(接種部位)†
2,894/4,375
66.1 (64.7–67.6)
1,293/4,378
29.5 (28.2–30.9)
筋肉痛**
2,025/4,375
46.3 (44.8–47.8)
530/4,378
12.1 (11.2–13.1)
倦怠感**
2,008/4,375
45.9 (44.4–47.4)
728/4,378
16.6 (15.5–17.8)
頭痛**
1,716/4,375
39.2 (37.8–40.7)
700/4,378
16.0 (14.9–17.1)
悪寒**
1,232/4,375
28.2 (26.8–29.5)
259/4,378
5.9 (5.2–6.7)
発熱**
939/4,375
21.5 (20.3–22.7)
132/4,378
3.0 (2.5–3.6)
消化器障害**
788/4,375
18.0 (16.9–19.2)
387/4,378
8.8 (8.0–9.7)
特定の有害事象(全身反応)**
41
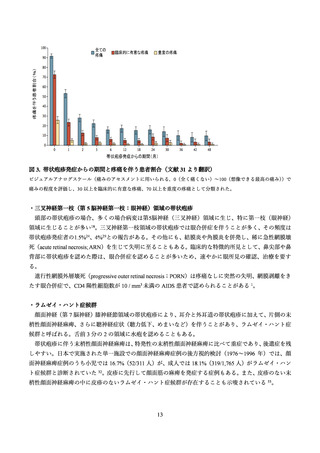
活に支障を来たすグレード 3 の症状が報告された。これらの症状の多くは、ワクチン接種群の 81.5%(グ
レード 3 は 9.5%)とプラセボ群の 11.9%(グレード 3 は 0.4%)に発現した特定の注射部位の反応及び、
ワクチン接種群の 66.1%(グレード 3 は 11.4%)とプラセボ群の 29.5%(グレード 3 は 2.4%)に発現した
全身反応であった。疼痛は接種部位反応では最も多く、ワクチン群の 79.1%、プラセボ群の 11.2%で報告
された。筋肉痛は全身反応で最も多く、ワクチン群の 46.3%、プラセボ群の 12.1%で報告された。反応は
一過性であり、特定の有害事象では持続期間の中央値は 1~3 日間であった。グレード 3 の反応における
持続期間の中央値は、すべての全身反応と疼痛では 1 日間、発赤と腫脹は 2 日間であった。接種回数ご
との頻度は同程度であったが、グレード 3 の特定の全身反応は、初回接種(5.9%;95%CI: 5.2~6.6)と比
較して 2 回目接種後(8.5%;95%CI: 7.7~9.4)の方が頻度は高かった。接種 30 日以内に 231 件の重篤な
有害事象が報告され(ワクチン群;103 件、プラセボ群;128 件)
、全参加者では 7,698 例中 87 例(1.1%)、
7,713 例中 97 例(1.3%)であった。
これらの事象のうち、治験責任者が接種と関連すると判断した重篤な有害事象は 4 例(ワクチン群 1
例、プラセボ群 3 例)であり、失神を伴う低血圧、単神経炎、感覚神経障害、筋骨格系の胸痛であった。
平均追跡期間の 3.5 年後までの重篤な有害事象は、ワクチン群 689 例(9.0%)、プラセボ群 686 例(8.9%)
と同程度であり、頻度が高い事象は心筋梗塞と心不全であった。ワクチン群 78 例(1.0%)とプラセボ群
97 例
(1.3%)では、
免疫介在疾患の総数や種類は同様であった。死亡は 341 例でワクチン群 167 例
(2.2%)、
プラセボ群 174 例(2.3%)であった。
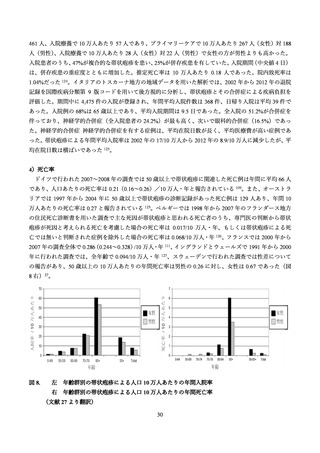
表 13. プラセボ群とワクチン群における有害事象
有害事象
ワクチン群
プラセボ群
%(95% CI)
参加人数
安全性評価サブグループ
4,460
%(95% CI)
参加人数
4,466
接種 30 日以内
有害事象報告(特定*のもの以外)
1308
29.3 (28.0-30.7)
1,226
27.5 (26.1-28.8)
上記のうち Grade3
208
4.7 (4.1-5.3)
151
3.4 (2.9-4.0)
3,765
84.4 (83.3–85.5)
1,689
37.8 (36.4–39.3)
上記のうち Grade3 の有害事象
760
17.0 (15.9–18.2)
145
3.2 (2.7–3.8)
上記のうち Grade3 の有害事象(接種に関連)
694
15.6 (14.5–16.7)
83
1.9 (1.5–2.3)
特定の有害事象(接種部位)*
3,571/4,382
81.5 (80.3–82.6)
522/4,377
11.9 (11.0–12.9)
疼痛*
3,464/4,382
79.1 (77.8–80.2)
490/4,377
11.2 (10.3–12.2)
発赤*
1,664/4,382
38.0 (36.5–39.4)
59/4,377
1.3 (1.0–1.7)
腫脹*
1,153/4,382
26.3 (25.0–27.6)
46/4,377
1.1 (0.8–1.4)
417/4,382
9.5 (8.7–10.4)
16/4,377
0.4 (0.2–0.6)
接種 7 日以内
全ての有害事象
Grade3 の特定の有害事象(接種部位)†
2,894/4,375
66.1 (64.7–67.6)
1,293/4,378
29.5 (28.2–30.9)
筋肉痛**
2,025/4,375
46.3 (44.8–47.8)
530/4,378
12.1 (11.2–13.1)
倦怠感**
2,008/4,375
45.9 (44.4–47.4)
728/4,378
16.6 (15.5–17.8)
頭痛**
1,716/4,375
39.2 (37.8–40.7)
700/4,378
16.0 (14.9–17.1)
悪寒**
1,232/4,375
28.2 (26.8–29.5)
259/4,378
5.9 (5.2–6.7)
発熱**
939/4,375
21.5 (20.3–22.7)
132/4,378
3.0 (2.5–3.6)
消化器障害**
788/4,375
18.0 (16.9–19.2)
387/4,378
8.8 (8.0–9.7)
特定の有害事象(全身反応)**
41