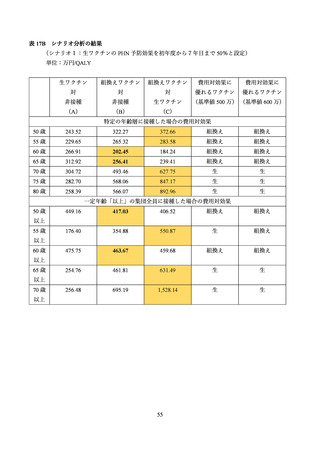
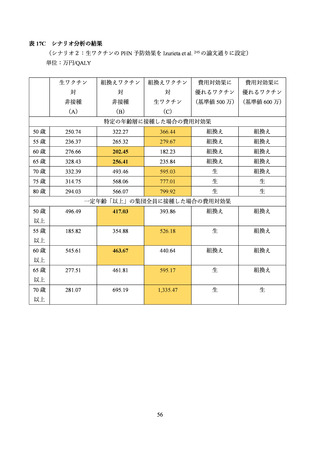
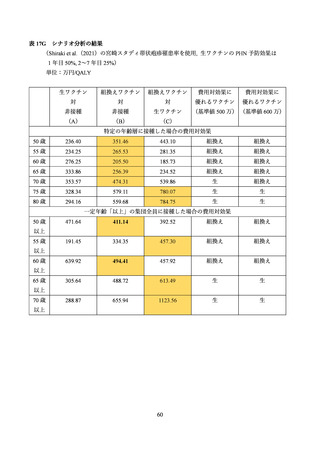
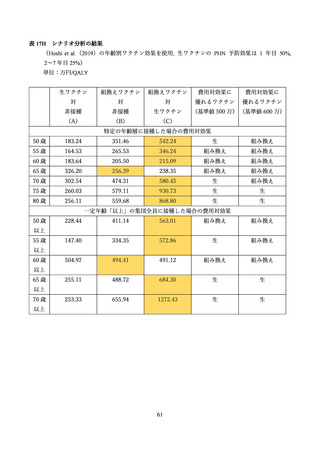
よむ、つかう、まなぶ。
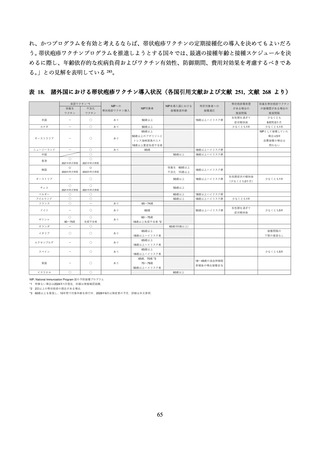
03 資料1-1 帯状疱疹ワクチンファクトシート (44 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_40826.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 予防接種基本方針部会 ワクチン評価に関する小委員会(第26回 6/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
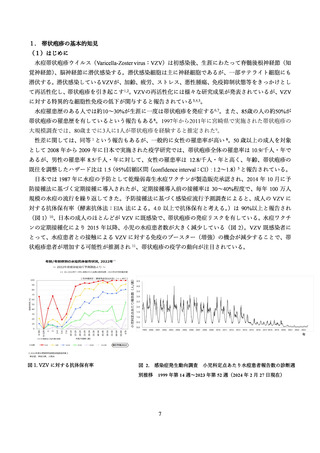
表 14. プラセボ群とワクチン群における有害事象
有害事象
ワクチン群
プラセボ群
症例数/合計
%(95% CI)
症例数/合計
%(95% CI)
全ての有害事象
399/505
79.0 (75.2–82.5)
149/505
29.5 (25.6–33.7)
Grade3 の有害事象
60/505
11.9 (9.2–15.0)
10/505
2.0 (1.0–3.6)
接種部位の反応
374/505
74.1 (70.0–77.8)
50/505
9.9 (7.4–12.8)
疼痛
347/505
68.7 (64.5–72.7)
43/505
8.5 (6.2–11.3)
発赤
198/505
39.2 (34.9–43.6)
5/505
1.0 (0.3–2.3)
腫脹
114/505
22.6 (19.0–26.5)
2/505
0.4 (0.0–1.4)
Grade3 の接種部位の反応†
43/505
8.5 (6.2–11.3)
1/505
0.2 (0.0–1.1)
全身反応
267/504
53.0 (48.5–57.4)
127/505
25.1 (21.4–29.2)
倦怠感
166/504
32.9 (28.8–37.2)
77/505
15.2 (12.2–18.7)
筋肉痛
157/504
31.2 (27.1–35.4)
41/505
8.1 (5.9–10.9)
頭痛
124/504
24.6 (20.9–28.6)
55/505
10.9 (8.3–13.9)
悪寒
75/504
14.9 (11.9–18.3)
22/505
4.4 (2.7–6.5)
発熱
62/504
12.3 (9.6–15.5)
13/505
2.6 (1.4–4.4)
消化器障害
55/504
10.9 (8.3–14.0)
40/505
7.9 (5.7–10.6)
Grade3 の全身反応
30/504
6.0 (4.1–8.4)
10/505
2.0 (1.0–3.6)
重篤な有害事象‡
1153/6,950
16.6 (15.7–17.5)
1214/6,950
17.5 (16.6–18.4)
重篤な有害事象(接種に関連§)
12/6,950
0.2 (0.1–0.3)
8/6,950
0.1 (0.0–0.2)
免疫介在疾患
92/6,950
1.3 (1.1–1.6)
97/6,950
1.4 (1.1–1.7)
死亡
426/6,950
6.1 (5.6–6.7)
459/6,950
6.6 (6.0–7.2)
安全性評価サブグループ(接種 7 日以内)
研究期間中の全参加者
†注射部位の発赤および腫脹における Grade は、直径 20mm 未満は 0、20mm 以上 50mm 未満を 1、50mm 以上 100mm 未満を 2、100mm 以上を 3 とした。体温は 37.5℃未
満を 0、37.5~38.0℃を 1 とした、39.0℃以上を 3 とした。
(口腔内での測定を推奨)その他の症状は、0:なし、1:耐えられる、2:日常の活動に影響する、3:日常の活
動を妨げるとされた。
‡
重篤な有害事象は、死亡に至ったもの、生命を脅かすもの、入院を要するまたは入院の延長を要したもの、障害または能力喪失に至ったものとした。
§
治験責任者が試験介入に関連するとされた有害事象は、ワクチン群ではリンパ節炎、心筋梗塞、潰瘍性大腸炎、急性膵炎、接種部位の紅斑、疼痛、悪寒、発熱、アレル
ギー性肉芽種性血管炎、細菌性関節炎、丹毒、帯状疱疹、湿疹、好中球減少性敗血症、急性骨髄性白血病、プラセボ群では、リウマチ性多発筋痛症、胃腺癌、脳梗塞、
脳血管障害、ギラン・バレー症候群、意識障害、失神、糸球体腎炎であった。参加者には、複数の症状に罹患した者もいた。
組換え帯状疱疹ワクチンの日本人における 50 歳以上及び 70 歳以上の有効性、安全性及び免疫原性 147(国
内、2018 年)
前述の研究 140 146 に日本から参加した 10 施設で登録された日本人集団のサブ解析が報告された。安全
性については、組み入れの際に年齢層を考慮した上で無作為に選択された日本人副反応部分集団 373 例
(ワクチン群 186 例、プラセボ群 187 例)を対象に解析された(表 15)。ワクチン群で最も頻度の高い局
所性特定有害事象は注射部位疼痛(89.2%)
、全身性特定有害事象は倦怠感(5.4%)であった。副反応は年
齢にかかわらず一過性であり、持続期間の中央値は局所性特定有害事象で 3~4 日、全身性特定有害事象
で 1~3 日、グレード 3 の特定有害事象で 1~2.5 日であった。局所性特定有害事象の頻度及び重症度は 70
43
有害事象
ワクチン群
プラセボ群
症例数/合計
%(95% CI)
症例数/合計
%(95% CI)
全ての有害事象
399/505
79.0 (75.2–82.5)
149/505
29.5 (25.6–33.7)
Grade3 の有害事象
60/505
11.9 (9.2–15.0)
10/505
2.0 (1.0–3.6)
接種部位の反応
374/505
74.1 (70.0–77.8)
50/505
9.9 (7.4–12.8)
疼痛
347/505
68.7 (64.5–72.7)
43/505
8.5 (6.2–11.3)
発赤
198/505
39.2 (34.9–43.6)
5/505
1.0 (0.3–2.3)
腫脹
114/505
22.6 (19.0–26.5)
2/505
0.4 (0.0–1.4)
Grade3 の接種部位の反応†
43/505
8.5 (6.2–11.3)
1/505
0.2 (0.0–1.1)
全身反応
267/504
53.0 (48.5–57.4)
127/505
25.1 (21.4–29.2)
倦怠感
166/504
32.9 (28.8–37.2)
77/505
15.2 (12.2–18.7)
筋肉痛
157/504
31.2 (27.1–35.4)
41/505
8.1 (5.9–10.9)
頭痛
124/504
24.6 (20.9–28.6)
55/505
10.9 (8.3–13.9)
悪寒
75/504
14.9 (11.9–18.3)
22/505
4.4 (2.7–6.5)
発熱
62/504
12.3 (9.6–15.5)
13/505
2.6 (1.4–4.4)
消化器障害
55/504
10.9 (8.3–14.0)
40/505
7.9 (5.7–10.6)
Grade3 の全身反応
30/504
6.0 (4.1–8.4)
10/505
2.0 (1.0–3.6)
重篤な有害事象‡
1153/6,950
16.6 (15.7–17.5)
1214/6,950
17.5 (16.6–18.4)
重篤な有害事象(接種に関連§)
12/6,950
0.2 (0.1–0.3)
8/6,950
0.1 (0.0–0.2)
免疫介在疾患
92/6,950
1.3 (1.1–1.6)
97/6,950
1.4 (1.1–1.7)
死亡
426/6,950
6.1 (5.6–6.7)
459/6,950
6.6 (6.0–7.2)
安全性評価サブグループ(接種 7 日以内)
研究期間中の全参加者
†注射部位の発赤および腫脹における Grade は、直径 20mm 未満は 0、20mm 以上 50mm 未満を 1、50mm 以上 100mm 未満を 2、100mm 以上を 3 とした。体温は 37.5℃未
満を 0、37.5~38.0℃を 1 とした、39.0℃以上を 3 とした。
(口腔内での測定を推奨)その他の症状は、0:なし、1:耐えられる、2:日常の活動に影響する、3:日常の活
動を妨げるとされた。
‡
重篤な有害事象は、死亡に至ったもの、生命を脅かすもの、入院を要するまたは入院の延長を要したもの、障害または能力喪失に至ったものとした。
§
治験責任者が試験介入に関連するとされた有害事象は、ワクチン群ではリンパ節炎、心筋梗塞、潰瘍性大腸炎、急性膵炎、接種部位の紅斑、疼痛、悪寒、発熱、アレル
ギー性肉芽種性血管炎、細菌性関節炎、丹毒、帯状疱疹、湿疹、好中球減少性敗血症、急性骨髄性白血病、プラセボ群では、リウマチ性多発筋痛症、胃腺癌、脳梗塞、
脳血管障害、ギラン・バレー症候群、意識障害、失神、糸球体腎炎であった。参加者には、複数の症状に罹患した者もいた。
組換え帯状疱疹ワクチンの日本人における 50 歳以上及び 70 歳以上の有効性、安全性及び免疫原性 147(国
内、2018 年)
前述の研究 140 146 に日本から参加した 10 施設で登録された日本人集団のサブ解析が報告された。安全
性については、組み入れの際に年齢層を考慮した上で無作為に選択された日本人副反応部分集団 373 例
(ワクチン群 186 例、プラセボ群 187 例)を対象に解析された(表 15)。ワクチン群で最も頻度の高い局
所性特定有害事象は注射部位疼痛(89.2%)
、全身性特定有害事象は倦怠感(5.4%)であった。副反応は年
齢にかかわらず一過性であり、持続期間の中央値は局所性特定有害事象で 3~4 日、全身性特定有害事象
で 1~3 日、グレード 3 の特定有害事象で 1~2.5 日であった。局所性特定有害事象の頻度及び重症度は 70
43