よむ、つかう、まなぶ。
資料4-2 令和5年度医療機器・再生医療等製品の自主回収一覧[2.0MB] (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41653.html |
| 出典情報 | 薬事審議会 医療機器・再生医療等製品安全対策部会(令和6年度第1回 8/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
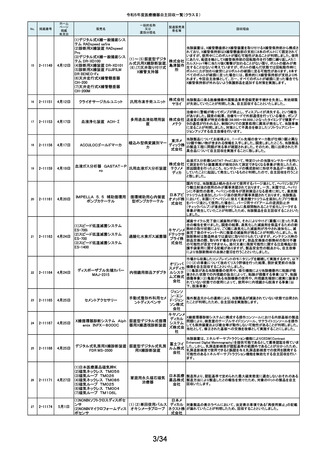
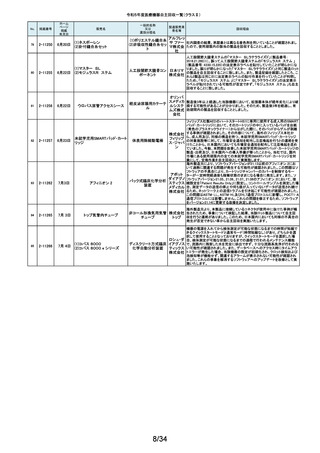
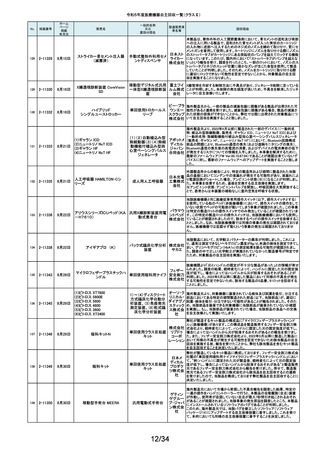
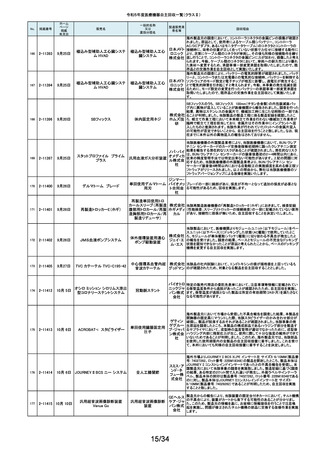
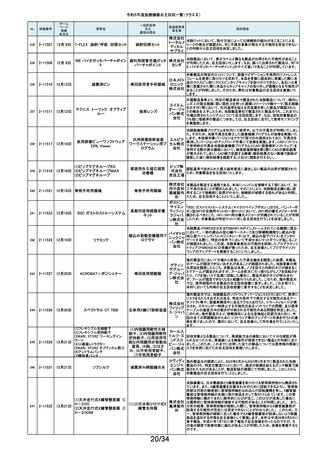
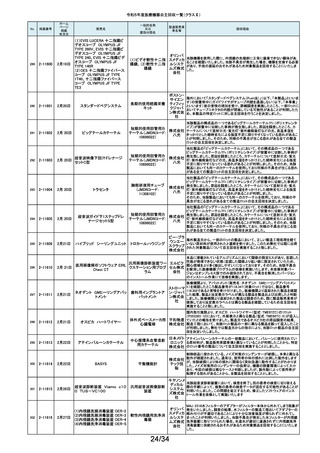
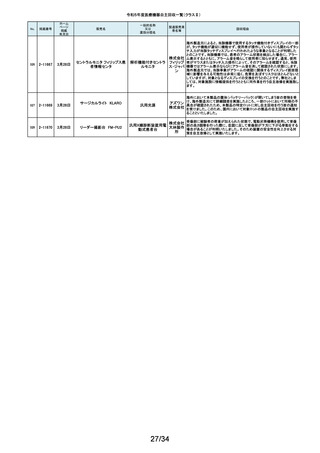
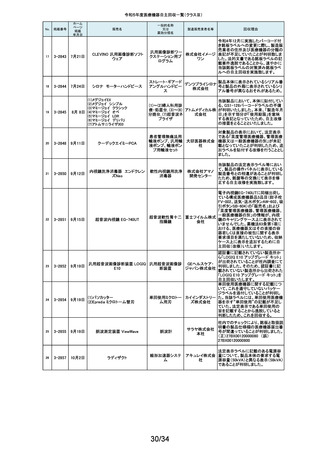
令和5年度医療機器自主回収一覧(クラスⅡ)
No.
掲載番号
ホーム
ページ
掲載
年月日
販売名
7月 24日
プラスマフェレーシス療法用回
路
一般的名称
又は
薬効分類名
製造販売業
者名等
回収理由
販売元から医療機関で回路を使用する際に開封したところ本来2種類の添付
111
2-11305
浪華ゴム 品(LM-15、輸液ライン)が入っているべきところ、同一添付品(LM-15)が2個
血漿分離用血液回路 工業株式 入っていたと連絡がありました。調査の結果、市場に同様の添付品収納誤り
会社 が複数ある可能性が否定できないため、回収を行う必要があると判断いたし
ました。
気道可逆性検査(BDテスト)実施時に弊社呼吸機能データサーバへ送信する
112
2-11307
7月26日
スーパースパイロ DISCOM-51
呼吸機能検査装置
チェスト株 プログラムにおいて操作手順によっては、本装置の一時データ保管フォルダ
内(TEMPフォルダ)で気道可逆性検査の吸入後データが、吸入前データに置
式会社 き換わってしまう不具合があることが判明いたしました。そのためソフトウェア
の自主改修を実施致します。
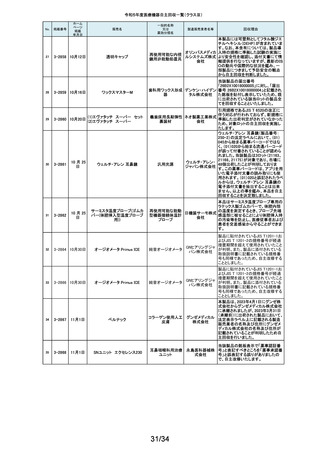
人工膝関節脛骨コンポーネントの「KR LimaVit ライナー」(製品番号:
6532.54.811)に誤って、人工膝関節脛骨コンポーネント「KR LimaVit ライナー」
(製品番号:6532.54.714)のラベルを
貼付していたことが明らかになりました。誤りが明らかになった「KR LimaVit ラ
人工膝関節脛骨コン
日本リマ イナー」と同じ製造ロットの製品を自主回収することとなりました。また、製造
ポーネント(人工膝関節
株式会社 記録を確認したところ、これら2製品は同じ日に法定表示ラベルの貼付作業を
膝蓋骨コンポーネント)
行っていたことが判明したため、「KR LimaVit ライナー」(製品番号:
6532.54.714)に、「KR LimaVit ライナー」(製品番号:6532.54.811)の法定ラベ
ルが貼付されている可能性が否定できないことから、上記2つのロットの自主
回収を実施することと致しました。
113
2-11308
7月27日
Physica KR LimaVit ライナー
114
2-11309
7月27日
ヘンケジェクト(HENKE-JEC
T)ディスポシリンジ
汎用注射筒
大阪ケミ 本品は滅菌済み単回使用の汎用注射筒ですが、製造所にて社内品質チェッ
クの過程で、当該ロット品において滅菌包装が損傷している可能性があること
カル株式 が判りました。この度弊社は、対象製品の滅菌性を保証できない可能性があ
会社 るため、自主回収を決定しました。
115
2-11310
7月27日
BOWA高周波電気手術器ARC
400
治療用電気手術器
株式会社 当該製品のリゲーションモード(リゲーション機能、Tissue Seal PLUS機能)の
オプション内に承認範囲外のARC Seal機能が搭載されていることを確認した
TKB ため、当該機能を無効化する自主回収を実施することとしました。
116
2-11311
7月28日
エリスマLP
脊椎内固定器具
バイオ 対象ロット中の製品本体に誤った製品番号と長さが刻印されているものがあ
ジェネシ ることが判明したため、自主回収を実施することと致しました。
製品番号 長さ
ス株式会 正: 18157540 40
社
誤: 18157545 45
117
2-11313
7月28日
モリア マイクロケラトーム
電動式ケラトーム用替
刃
株式会社 当該製品(M2ブレード)に組み込まれている内刃が、プラスチック製のヘッド
モリア・ の適正な位置に取りつけられていない可能性が認められたため、自主回収を
ジャパン 行うことと致しました。
挿入器付後房レンズ
本品において、眼内レンズ埋植後、眼圧が上昇したとの報告を全世界で2件
受領しました。これらの症例の報告受領に先行して、本品と同一又は類似の
スター・ 原材料、製造工程で製造され、他社にて製造販売されている挿入器付後房レ
ンズ(以下「他社品」と記す)について、当該他社において、眼圧上昇の症例
ジャパン の報告受領数が増加しました。弊社では、この事実を踏まえ、眼圧上昇の原
合同会社 因について調査を実施しましたが、根本原因を特定することができませんでし
た。このことから、慎重を期すため、当該製品を自主回収することといたしまし
た。
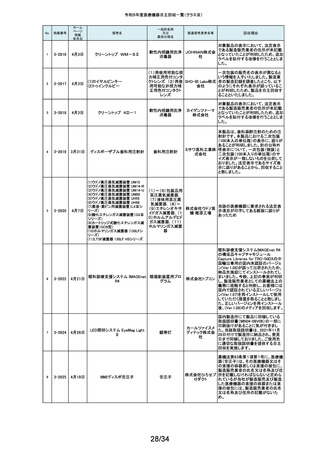
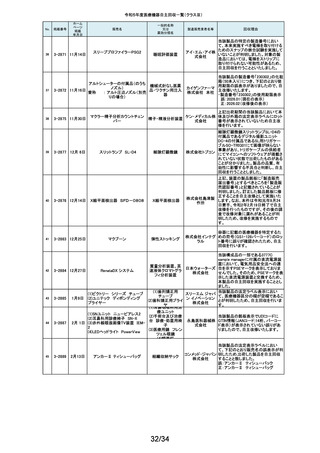
118
119
2-11318
8月 2日
アクリロードシステム SP
2-11319
(1)一般外科キット
(2)脳外科キット
8月 3日
(3)泌尿器科キット
(4)整形外科キット
キット構成品であるテルフュージョン輸液セット20滴≒1ml(DEHPフリー)をキッ
株式会社 トへ投入するための承認内容は、構成品供給元の滅菌方法がEOG滅菌済み
単回使用クラスⅣ処置
ホギメディ 品もしくはγ線滅菌済み品を購入しキットの構成品としますが、電子線滅菌済
キット
み品を購入し、キットの構成品として使用していることが判明したため、当該
カル
構成品が含まれたキットを自主回収することとしました。
日常点検開始時、若しくは測定開始時に、装置の温度制御対象ユニットの温
120
2-11320
8月 3日
全自動化学発光酵素免疫測定
装置 AIA-CL300
免疫発光測定装置
東ソー株 度が正常な状態にもかかわらず、温度制御のタイミングによっては稀に温度
下限のエラーが発生し、装置の再起動が必要になる場合があることが判明し
式会社 ました。このため、当該装置のプログラムを修正したソフトウェアに変更する改
修作業を実施します。
121
2-11321
8月 7日
エフエムディ ガイドワイヤー
株式会社 対象製品①の製品箱を開封したところ、滅菌包装及び製品本体が異なる製
心臓・中心循環系用カ
品②が混在していた旨の報告を医療機関より受理致しました。対象ロット間で
エフエム 製品の入れ間違いが生じている可能性がある為、入れ間違いが生じている
テーテルガイドワイヤー
ディ
可能性が否定できないロットについて自主的に回収することとします。
テレフレッ 海外製造元より、オブチュレータチューブとシースロックの溶着が不十分のた
クスメディ めオブチュレータの固定位置がずれたり、オブチュレータチューブとシースロッ
カルジャ クに隙間が生じる恐れがあることが判明し、当該ロット製品について自主回収
パン株式 を行うと連絡がありました。このため、日本国内においても同様の不具合の発
会社 生が否定できない事から自主回収を実施いたします。
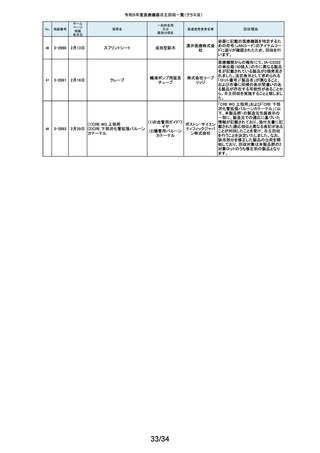
122
2-11322
8月7日
UL ビジュアルオブチュレータ
内視鏡用オブチュレー
タ
123
2-11323
8月 7日
VIM-NT
歯列矯正用ワイヤ
株式会社 パッケージに記載している商品名(ラベル)と異なる型番の製品が入っていた
ため。
オーラル 正・・・NT-602(ニッケルチタン スムースアーチフォーム 0.012”)
ケア
誤・・・D-ベンドワイヤー 0.012”
124
2-11324
8月 7日
ディスポーザブルアンギオキット
血管造影キット
スーガン 承認書に記載された内容とは異なる材料で製造されたモニタリングチューブ
のコネクタが組み込まれていたことが判明したため、当該ロット番号の製品を
株式会社 自主回収することと致しました。
「Hugo RAS システム」におきまして、アームカートの術前キャリブレーション中
125
2-11325
8月 9日
Hugo RAS システム
コヴィディ におけるシステムエラーとその対処方法について、2022年12月より情報提供
手術用ロボット手術ユ エン ジャ を実施しておりました。この情報提供の中で、当該事象が発生した場合は
アームカートキャリブレーションガイドに従って対処することをご案内し、今後
ニット
パン株式 の対応につきましては修正ソフトウェアの準備が完了次第、速やかに対応さ
会社 せていただくことをお知らせいたしました。今般、修正ソフトウェアの準備が完
了しましたので、ソフトウェアバージョンアップの自主改修を実施いたします。
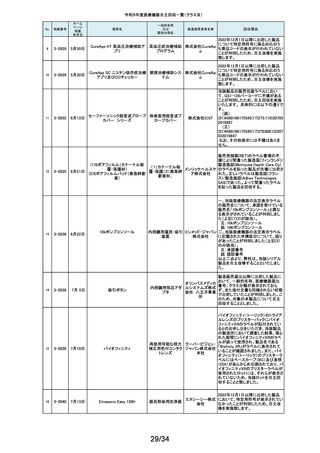
126
127
2-11327
2-11328
8月 9日
カムログボーンプロファイラー
手術用ドリルビット
株式会社 当該製品(ボーンプロファイラー 5.0 (3.3mm用))は専用のピンを軸にして使用
アルタデ しますが、形成に不具合があり、ピンが入らない可能性があることが判明した
ため、当該ロット全品を回収します。
ント
8月15日
(1)PDS縫合糸
(2)PDS プラス
ポリジオキサノン縫合
糸
ジョンソ
ン・エン
PDS縫合糸及びPDS プラスについて糸の結節抗張力が規格値を下回ってい
ド・ジョン る可能性が考えられたため、自主回収することとしました。
ソン株式
会社
11/34
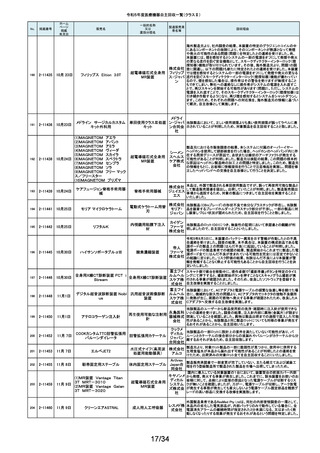
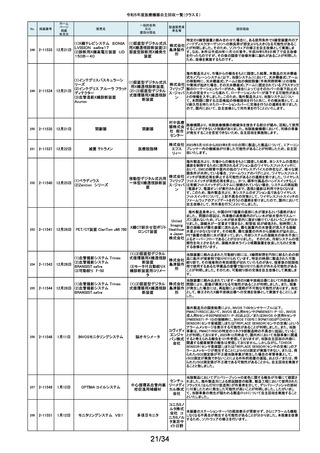
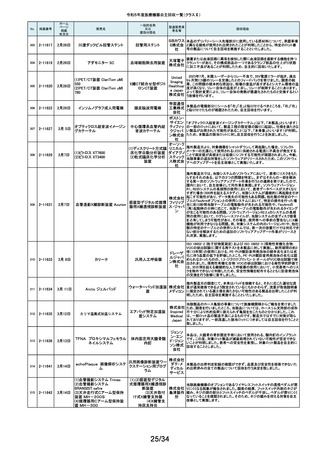
No.
掲載番号
ホーム
ページ
掲載
年月日
販売名
7月 24日
プラスマフェレーシス療法用回
路
一般的名称
又は
薬効分類名
製造販売業
者名等
回収理由
販売元から医療機関で回路を使用する際に開封したところ本来2種類の添付
111
2-11305
浪華ゴム 品(LM-15、輸液ライン)が入っているべきところ、同一添付品(LM-15)が2個
血漿分離用血液回路 工業株式 入っていたと連絡がありました。調査の結果、市場に同様の添付品収納誤り
会社 が複数ある可能性が否定できないため、回収を行う必要があると判断いたし
ました。
気道可逆性検査(BDテスト)実施時に弊社呼吸機能データサーバへ送信する
112
2-11307
7月26日
スーパースパイロ DISCOM-51
呼吸機能検査装置
チェスト株 プログラムにおいて操作手順によっては、本装置の一時データ保管フォルダ
内(TEMPフォルダ)で気道可逆性検査の吸入後データが、吸入前データに置
式会社 き換わってしまう不具合があることが判明いたしました。そのためソフトウェア
の自主改修を実施致します。
人工膝関節脛骨コンポーネントの「KR LimaVit ライナー」(製品番号:
6532.54.811)に誤って、人工膝関節脛骨コンポーネント「KR LimaVit ライナー」
(製品番号:6532.54.714)のラベルを
貼付していたことが明らかになりました。誤りが明らかになった「KR LimaVit ラ
人工膝関節脛骨コン
日本リマ イナー」と同じ製造ロットの製品を自主回収することとなりました。また、製造
ポーネント(人工膝関節
株式会社 記録を確認したところ、これら2製品は同じ日に法定表示ラベルの貼付作業を
膝蓋骨コンポーネント)
行っていたことが判明したため、「KR LimaVit ライナー」(製品番号:
6532.54.714)に、「KR LimaVit ライナー」(製品番号:6532.54.811)の法定ラベ
ルが貼付されている可能性が否定できないことから、上記2つのロットの自主
回収を実施することと致しました。
113
2-11308
7月27日
Physica KR LimaVit ライナー
114
2-11309
7月27日
ヘンケジェクト(HENKE-JEC
T)ディスポシリンジ
汎用注射筒
大阪ケミ 本品は滅菌済み単回使用の汎用注射筒ですが、製造所にて社内品質チェッ
クの過程で、当該ロット品において滅菌包装が損傷している可能性があること
カル株式 が判りました。この度弊社は、対象製品の滅菌性を保証できない可能性があ
会社 るため、自主回収を決定しました。
115
2-11310
7月27日
BOWA高周波電気手術器ARC
400
治療用電気手術器
株式会社 当該製品のリゲーションモード(リゲーション機能、Tissue Seal PLUS機能)の
オプション内に承認範囲外のARC Seal機能が搭載されていることを確認した
TKB ため、当該機能を無効化する自主回収を実施することとしました。
116
2-11311
7月28日
エリスマLP
脊椎内固定器具
バイオ 対象ロット中の製品本体に誤った製品番号と長さが刻印されているものがあ
ジェネシ ることが判明したため、自主回収を実施することと致しました。
製品番号 長さ
ス株式会 正: 18157540 40
社
誤: 18157545 45
117
2-11313
7月28日
モリア マイクロケラトーム
電動式ケラトーム用替
刃
株式会社 当該製品(M2ブレード)に組み込まれている内刃が、プラスチック製のヘッド
モリア・ の適正な位置に取りつけられていない可能性が認められたため、自主回収を
ジャパン 行うことと致しました。
挿入器付後房レンズ
本品において、眼内レンズ埋植後、眼圧が上昇したとの報告を全世界で2件
受領しました。これらの症例の報告受領に先行して、本品と同一又は類似の
スター・ 原材料、製造工程で製造され、他社にて製造販売されている挿入器付後房レ
ンズ(以下「他社品」と記す)について、当該他社において、眼圧上昇の症例
ジャパン の報告受領数が増加しました。弊社では、この事実を踏まえ、眼圧上昇の原
合同会社 因について調査を実施しましたが、根本原因を特定することができませんでし
た。このことから、慎重を期すため、当該製品を自主回収することといたしまし
た。
118
119
2-11318
8月 2日
アクリロードシステム SP
2-11319
(1)一般外科キット
(2)脳外科キット
8月 3日
(3)泌尿器科キット
(4)整形外科キット
キット構成品であるテルフュージョン輸液セット20滴≒1ml(DEHPフリー)をキッ
株式会社 トへ投入するための承認内容は、構成品供給元の滅菌方法がEOG滅菌済み
単回使用クラスⅣ処置
ホギメディ 品もしくはγ線滅菌済み品を購入しキットの構成品としますが、電子線滅菌済
キット
み品を購入し、キットの構成品として使用していることが判明したため、当該
カル
構成品が含まれたキットを自主回収することとしました。
日常点検開始時、若しくは測定開始時に、装置の温度制御対象ユニットの温
120
2-11320
8月 3日
全自動化学発光酵素免疫測定
装置 AIA-CL300
免疫発光測定装置
東ソー株 度が正常な状態にもかかわらず、温度制御のタイミングによっては稀に温度
下限のエラーが発生し、装置の再起動が必要になる場合があることが判明し
式会社 ました。このため、当該装置のプログラムを修正したソフトウェアに変更する改
修作業を実施します。
121
2-11321
8月 7日
エフエムディ ガイドワイヤー
株式会社 対象製品①の製品箱を開封したところ、滅菌包装及び製品本体が異なる製
心臓・中心循環系用カ
品②が混在していた旨の報告を医療機関より受理致しました。対象ロット間で
エフエム 製品の入れ間違いが生じている可能性がある為、入れ間違いが生じている
テーテルガイドワイヤー
ディ
可能性が否定できないロットについて自主的に回収することとします。
テレフレッ 海外製造元より、オブチュレータチューブとシースロックの溶着が不十分のた
クスメディ めオブチュレータの固定位置がずれたり、オブチュレータチューブとシースロッ
カルジャ クに隙間が生じる恐れがあることが判明し、当該ロット製品について自主回収
パン株式 を行うと連絡がありました。このため、日本国内においても同様の不具合の発
会社 生が否定できない事から自主回収を実施いたします。
122
2-11322
8月7日
UL ビジュアルオブチュレータ
内視鏡用オブチュレー
タ
123
2-11323
8月 7日
VIM-NT
歯列矯正用ワイヤ
株式会社 パッケージに記載している商品名(ラベル)と異なる型番の製品が入っていた
ため。
オーラル 正・・・NT-602(ニッケルチタン スムースアーチフォーム 0.012”)
ケア
誤・・・D-ベンドワイヤー 0.012”
124
2-11324
8月 7日
ディスポーザブルアンギオキット
血管造影キット
スーガン 承認書に記載された内容とは異なる材料で製造されたモニタリングチューブ
のコネクタが組み込まれていたことが判明したため、当該ロット番号の製品を
株式会社 自主回収することと致しました。
「Hugo RAS システム」におきまして、アームカートの術前キャリブレーション中
125
2-11325
8月 9日
Hugo RAS システム
コヴィディ におけるシステムエラーとその対処方法について、2022年12月より情報提供
手術用ロボット手術ユ エン ジャ を実施しておりました。この情報提供の中で、当該事象が発生した場合は
アームカートキャリブレーションガイドに従って対処することをご案内し、今後
ニット
パン株式 の対応につきましては修正ソフトウェアの準備が完了次第、速やかに対応さ
会社 せていただくことをお知らせいたしました。今般、修正ソフトウェアの準備が完
了しましたので、ソフトウェアバージョンアップの自主改修を実施いたします。
126
127
2-11327
2-11328
8月 9日
カムログボーンプロファイラー
手術用ドリルビット
株式会社 当該製品(ボーンプロファイラー 5.0 (3.3mm用))は専用のピンを軸にして使用
アルタデ しますが、形成に不具合があり、ピンが入らない可能性があることが判明した
ため、当該ロット全品を回収します。
ント
8月15日
(1)PDS縫合糸
(2)PDS プラス
ポリジオキサノン縫合
糸
ジョンソ
ン・エン
PDS縫合糸及びPDS プラスについて糸の結節抗張力が規格値を下回ってい
ド・ジョン る可能性が考えられたため、自主回収することとしました。
ソン株式
会社
11/34