よむ、つかう、まなぶ。
資料4-2 令和5年度医療機器・再生医療等製品の自主回収一覧[2.0MB] (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41653.html |
| 出典情報 | 薬事審議会 医療機器・再生医療等製品安全対策部会(令和6年度第1回 8/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
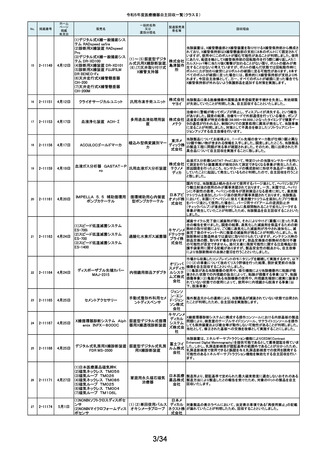
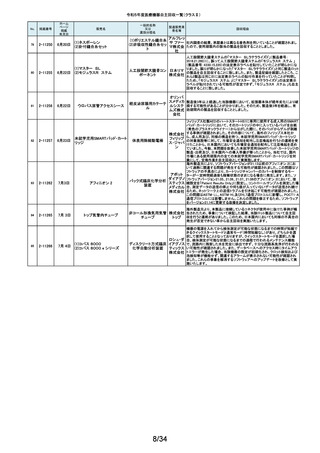
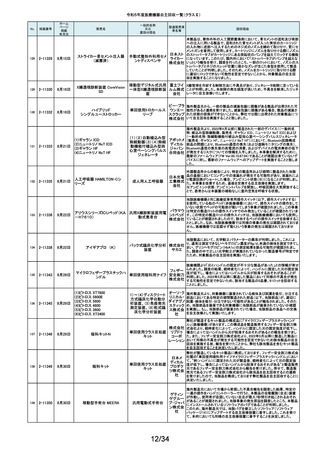
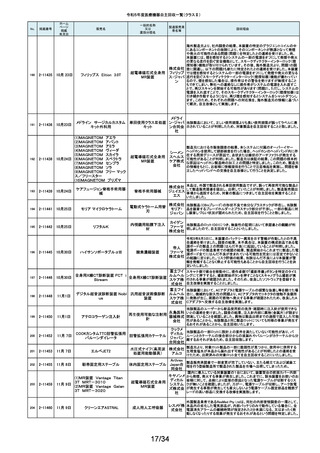
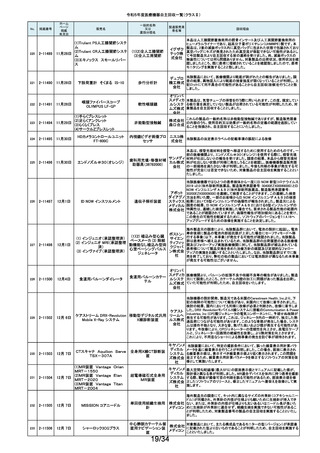
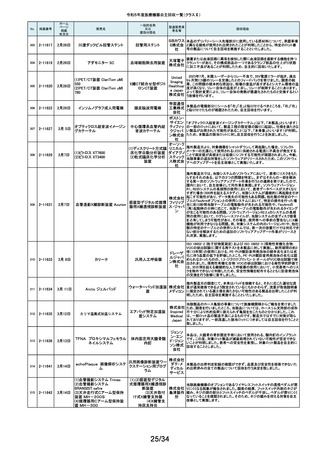
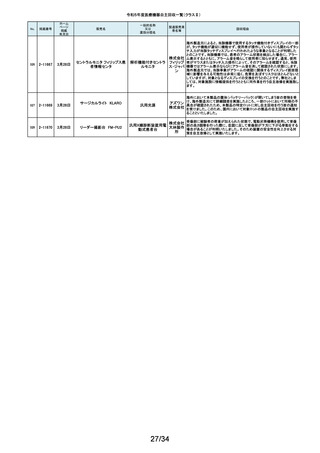
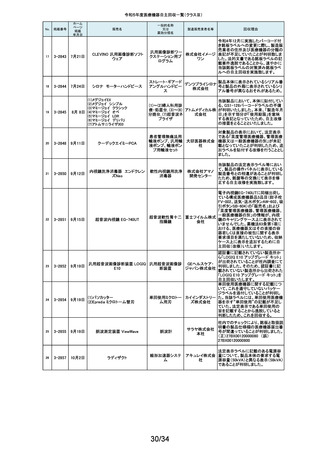
令和5年度医療機器自主回収一覧(クラスⅡ)
No.
掲載番号
ホーム
ページ
掲載
年月日
販売名
一般的名称
又は
薬効分類名
166
2-11393
9月25日
植込み型補助人工心臓システ
ム HVAD
植込み型補助人工心
臓システム
167
2-11394
9月25日
植込み型補助人工心臓システ
ム HVAD
植込み型補助人工心
臓システム
168
2-11396
9月20日
SBフィックス
体内固定用ネジ
製造販売業
者名等
回収理由
海外製造元の調査において、コントローラコネクタの金属ピンの損傷が確認さ
れました。原因として、使用者によるケーブル類(バッテリー、コントローラ
AC/DCアダプタ、あるいはモニタデータケーブル)のコネクタとコントローラの
日本メドト 接続時に、両者の位置が正しく合っていない状態で力任せに接続する動作に
ロニック より、次第にケーブル類のコネクタが摩耗し、その後も同様の接続動作を繰り
株式会社 返し行うことで、コントローラコネクタの金属ピンに力が加わり、損傷したと考え
られます。今般、ケーブル類のコネクタにおいて、摩耗への耐久性により優れ
た素材へ変更するため、承認事項一部変更承認を取得いたしましたので、既
存品との交換作業を自主回収として実施いたします。
海外製造元の調査により、バッテリーの電気的障害が確認されました。バッテ
リーと、コントローラまたは充電器との電気的な接続時、バッテリーを制御する
日本メドト ソフトウェアのモード設定と電子チップが相互に影響し、過電圧が発生するこ
ロニック とで電気的障害を引き起こすと考えられます。今般、本事象の発生低減を図
株式会社 るために、モード設定の変更を行ったバッテリーの承認事項一部変更承認を
取得いたしましたので、既存品との交換作業を自主回収として実施いたしま
す。
SBフィックスのうち,SBフィックス 100mm(チタン合金製)の内包装滅菌バッ
グ内に異物が混入していることが医療機関から報告されました。調査を行った
結果,異物はステンレスの金属片で,機械加工時に生じた切削粉の一部であ
株式会社 ることが判明しました。当該製品の製造工程に係る製造記録を確認したとこ
ホムズ技 ろ,組立て作業工程において本来組立て作業を行わない機械加工作業者が
臨時で組立て工程を担当しており,金属片はその作業中にインプラントへ混
研
入したものと推測されます。当該作業が行われていたロットへの金属片混入
の可能性が否定できないことから,自主回収を行うことと致しました。なお,現
在までに本件以外の異物混入の報告はされておりません。
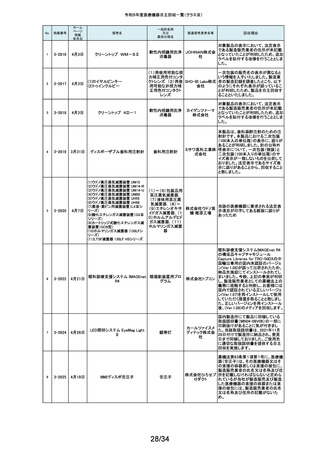
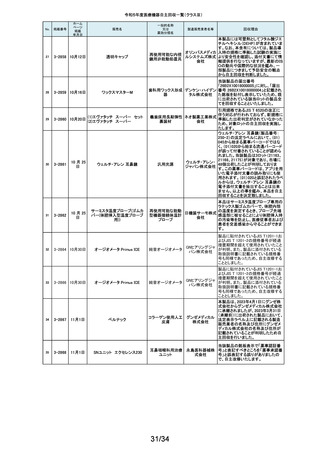
169
2-11397
9月25日
スタットプロファイル プライム
プラス
当該医療機器の外国製造業者により、当該医療機器において、BUN/クレア
チニン センサーカードのカード交換後稼働初期時に誤ったクレアチニン測定
ノバ・バイ 結果を報告する潜在的なリスクがあることが確認されました。潜在的なリスク
オメディカ は、BUN/クレアチニン センサーカードの装着後最初の2~4時間以内にあり、
従来の精度管理手法では特定出来ない可能性があります。上記の問題に対
汎用血液ガス分析装置
ル株式会 応するため、当該医療機器の外国製造業者より、BUN/クレアチニン セン
社
サーカード装着後4時間以内における自動較正の実施頻度を高める修正版ソ
フトウェアがリリースされました。以上の理由から、弊社は当該医療機器のソ
フトウェアバージョンアップによる改修を実施いたします。
170
2-11400
9月26日
デルマトーム ブレード
ジンマー・
単回使用デルマトーム バイオメッ ブレードの一部に鈍部があり、採皮が不均一となって追加の採皮が必要とな
用刃
ト合同会 る可能性があるため、回収を実施します。
社
再製造トロッカーE(ホギ)
再製造単回使用トロ
カールスリーブ(再製造 株式会社 当該再製造医療機器の「再製造トロッカーE(ホギ)」におきまして、検査記録
腹部用トロカール/再製 ホギメディ (性能検査;スリーブとトロッカーの接続検査)の一部に記載されていない箇所
があり、接続性に担保が無いため、自主回収することを決定いたしました。
造胸部用トロカール/再
カル
製造リデューサ)
171
2-11401
9月26日
172
2-11402
9月26日
JMS血液ポンプシステム
173
2-11405
9月27日
TVC カテーテル TVC-C195-42
174
2-11412
10月 5日
オシロ ミッション シロリムス溶出
型コロナリーステントシステム
体外循環装置用遠心
ポンプ駆動装置
当該製品において、医療機関よりモジュールユニット(以下モジュール)をベー
スユニット(以下ベース)にドッキングした状態(AC駆動)で使用していたとこ
株式会社 ろ、モジュールが単体駆動(バッテリ駆動)に切り替わる不具合が発生したと
ジェイ・エ の報告を受けました。調査の結果、ベースとモジュールの不完全なドッキング
ム・エス 状態を認知できなかったことが原因と考えられたことから、ベースのドッキング
機構を変更する自主回収を実施します。
中心循環系血管内超 株式会社 当該品の社内試験において、エンドトキシンの値が規格値を上回っているも
音波カテーテル
グッドマン のが確認されたため、対象となる製品を自主回収することとしました。
冠動脈ステント
バイオトロ 特定の販売代理店の委託先倉庫において、注意事項等情報に記載されてい
ニックジャ る保管温度条件から逸脱があったことが確認されたため、自主回収を実施し
パン株式 ます。保管温度が逸脱となった製品は所定の有効期間(24か月)を満たさなく
会社 なる可能性があります。
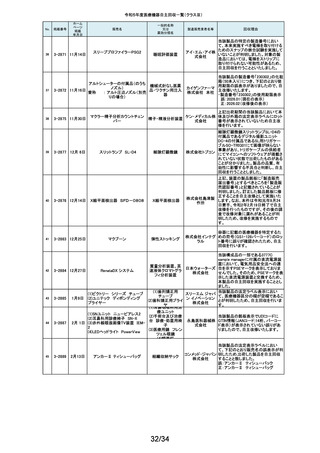
海外製造元において市場から受領した不具合報告を調査した結果、本製品を
開胸器の固定具にマウントした際、当該スタビライザーのかみ合わせ部分が
175
2-11413
10月 6日
ACROBAT-i スタビライザー
ゲティン 破損し、製品が脱落するおそれがあることが確認されました。当該事象の発
ゲグルー 生原因を調査したところ、本製品の構成部品であるハウジング部分を製造す
単回使用臓器固定用
プ・ジャパ るサプライヤにおいて、成型時の温度管理が適切でなかったために、成型後
圧子
ン株式会 ハウジング内部に残留応力が生じ、使用に際して十分な強度の維持ができて
いないためであることが判明しました。このため、海外製造元では、当該部品
社
を使用した使用期限内の全製品の自主回収措置に着手しました。これを受け
て、本邦においても同様の自主回収措置に着手することを決定しました。
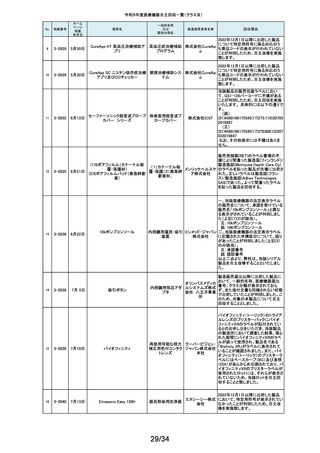
176
177
2-11414
10月 6日 JOURNEY II BCS ニー システム
2-11415 10月 10日
汎用超音波画像診断装置
Venue Go
全人工膝関節
海外市場よりJOURNEY II BCS XLPE インサート左 サイズ5-6/10MM(製品番
号:74027262、ロット番号:22BM18348)の製品を開封したところ、製品本体は
スミス・ア JOURNEY II コンストレインドインサートであったとの不具合報告を受領し、米
ンド・ネ 国製造元において当該事象の調査を実施致しました。製造記録に基づく調査
の結果、ある特定の2ロット間で入れ違いが発生し、外箱ラベルやインナーラ
フュー株 ベル、製品本体の刻印は製品番号:74027262、ロット番号:22BM18348である
式会社 のに対し、製品本体はJOURNEY IIコンストレインドインサート左 サイズ56/10MM(製品番号:74029262)であることが判明したため、自主回収を実施
することと致しました。
GEヘルス 製造元からの報告により、当該装置の固定台付きカートにおいて、チルト機構
汎用超音波画像診断 ケア・ジャ の不具合により、装置がカートから落下する可能性のあることが分かりまし
た。このため、製造元の情報を基に、お客様に情報提供を行うことで注意喚
装置
パン株式 起を実施し、問題が修正されたチルト機構の部品に交換する改修作業を実施
会社 します。
15/34
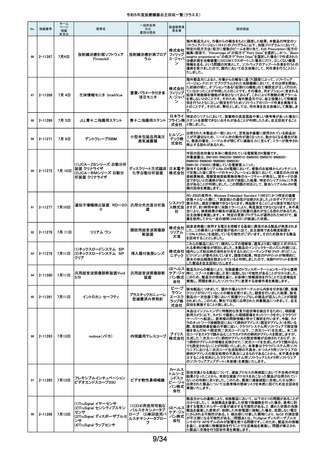
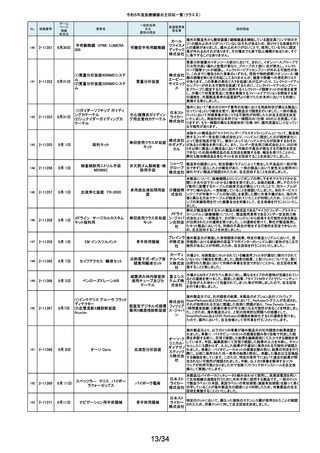
No.
掲載番号
ホーム
ページ
掲載
年月日
販売名
一般的名称
又は
薬効分類名
166
2-11393
9月25日
植込み型補助人工心臓システ
ム HVAD
植込み型補助人工心
臓システム
167
2-11394
9月25日
植込み型補助人工心臓システ
ム HVAD
植込み型補助人工心
臓システム
168
2-11396
9月20日
SBフィックス
体内固定用ネジ
製造販売業
者名等
回収理由
海外製造元の調査において、コントローラコネクタの金属ピンの損傷が確認さ
れました。原因として、使用者によるケーブル類(バッテリー、コントローラ
AC/DCアダプタ、あるいはモニタデータケーブル)のコネクタとコントローラの
日本メドト 接続時に、両者の位置が正しく合っていない状態で力任せに接続する動作に
ロニック より、次第にケーブル類のコネクタが摩耗し、その後も同様の接続動作を繰り
株式会社 返し行うことで、コントローラコネクタの金属ピンに力が加わり、損傷したと考え
られます。今般、ケーブル類のコネクタにおいて、摩耗への耐久性により優れ
た素材へ変更するため、承認事項一部変更承認を取得いたしましたので、既
存品との交換作業を自主回収として実施いたします。
海外製造元の調査により、バッテリーの電気的障害が確認されました。バッテ
リーと、コントローラまたは充電器との電気的な接続時、バッテリーを制御する
日本メドト ソフトウェアのモード設定と電子チップが相互に影響し、過電圧が発生するこ
ロニック とで電気的障害を引き起こすと考えられます。今般、本事象の発生低減を図
株式会社 るために、モード設定の変更を行ったバッテリーの承認事項一部変更承認を
取得いたしましたので、既存品との交換作業を自主回収として実施いたしま
す。
SBフィックスのうち,SBフィックス 100mm(チタン合金製)の内包装滅菌バッ
グ内に異物が混入していることが医療機関から報告されました。調査を行った
結果,異物はステンレスの金属片で,機械加工時に生じた切削粉の一部であ
株式会社 ることが判明しました。当該製品の製造工程に係る製造記録を確認したとこ
ホムズ技 ろ,組立て作業工程において本来組立て作業を行わない機械加工作業者が
臨時で組立て工程を担当しており,金属片はその作業中にインプラントへ混
研
入したものと推測されます。当該作業が行われていたロットへの金属片混入
の可能性が否定できないことから,自主回収を行うことと致しました。なお,現
在までに本件以外の異物混入の報告はされておりません。
169
2-11397
9月25日
スタットプロファイル プライム
プラス
当該医療機器の外国製造業者により、当該医療機器において、BUN/クレア
チニン センサーカードのカード交換後稼働初期時に誤ったクレアチニン測定
ノバ・バイ 結果を報告する潜在的なリスクがあることが確認されました。潜在的なリスク
オメディカ は、BUN/クレアチニン センサーカードの装着後最初の2~4時間以内にあり、
従来の精度管理手法では特定出来ない可能性があります。上記の問題に対
汎用血液ガス分析装置
ル株式会 応するため、当該医療機器の外国製造業者より、BUN/クレアチニン セン
社
サーカード装着後4時間以内における自動較正の実施頻度を高める修正版ソ
フトウェアがリリースされました。以上の理由から、弊社は当該医療機器のソ
フトウェアバージョンアップによる改修を実施いたします。
170
2-11400
9月26日
デルマトーム ブレード
ジンマー・
単回使用デルマトーム バイオメッ ブレードの一部に鈍部があり、採皮が不均一となって追加の採皮が必要とな
用刃
ト合同会 る可能性があるため、回収を実施します。
社
再製造トロッカーE(ホギ)
再製造単回使用トロ
カールスリーブ(再製造 株式会社 当該再製造医療機器の「再製造トロッカーE(ホギ)」におきまして、検査記録
腹部用トロカール/再製 ホギメディ (性能検査;スリーブとトロッカーの接続検査)の一部に記載されていない箇所
があり、接続性に担保が無いため、自主回収することを決定いたしました。
造胸部用トロカール/再
カル
製造リデューサ)
171
2-11401
9月26日
172
2-11402
9月26日
JMS血液ポンプシステム
173
2-11405
9月27日
TVC カテーテル TVC-C195-42
174
2-11412
10月 5日
オシロ ミッション シロリムス溶出
型コロナリーステントシステム
体外循環装置用遠心
ポンプ駆動装置
当該製品において、医療機関よりモジュールユニット(以下モジュール)をベー
スユニット(以下ベース)にドッキングした状態(AC駆動)で使用していたとこ
株式会社 ろ、モジュールが単体駆動(バッテリ駆動)に切り替わる不具合が発生したと
ジェイ・エ の報告を受けました。調査の結果、ベースとモジュールの不完全なドッキング
ム・エス 状態を認知できなかったことが原因と考えられたことから、ベースのドッキング
機構を変更する自主回収を実施します。
中心循環系血管内超 株式会社 当該品の社内試験において、エンドトキシンの値が規格値を上回っているも
音波カテーテル
グッドマン のが確認されたため、対象となる製品を自主回収することとしました。
冠動脈ステント
バイオトロ 特定の販売代理店の委託先倉庫において、注意事項等情報に記載されてい
ニックジャ る保管温度条件から逸脱があったことが確認されたため、自主回収を実施し
パン株式 ます。保管温度が逸脱となった製品は所定の有効期間(24か月)を満たさなく
会社 なる可能性があります。
海外製造元において市場から受領した不具合報告を調査した結果、本製品を
開胸器の固定具にマウントした際、当該スタビライザーのかみ合わせ部分が
175
2-11413
10月 6日
ACROBAT-i スタビライザー
ゲティン 破損し、製品が脱落するおそれがあることが確認されました。当該事象の発
ゲグルー 生原因を調査したところ、本製品の構成部品であるハウジング部分を製造す
単回使用臓器固定用
プ・ジャパ るサプライヤにおいて、成型時の温度管理が適切でなかったために、成型後
圧子
ン株式会 ハウジング内部に残留応力が生じ、使用に際して十分な強度の維持ができて
いないためであることが判明しました。このため、海外製造元では、当該部品
社
を使用した使用期限内の全製品の自主回収措置に着手しました。これを受け
て、本邦においても同様の自主回収措置に着手することを決定しました。
176
177
2-11414
10月 6日 JOURNEY II BCS ニー システム
2-11415 10月 10日
汎用超音波画像診断装置
Venue Go
全人工膝関節
海外市場よりJOURNEY II BCS XLPE インサート左 サイズ5-6/10MM(製品番
号:74027262、ロット番号:22BM18348)の製品を開封したところ、製品本体は
スミス・ア JOURNEY II コンストレインドインサートであったとの不具合報告を受領し、米
ンド・ネ 国製造元において当該事象の調査を実施致しました。製造記録に基づく調査
の結果、ある特定の2ロット間で入れ違いが発生し、外箱ラベルやインナーラ
フュー株 ベル、製品本体の刻印は製品番号:74027262、ロット番号:22BM18348である
式会社 のに対し、製品本体はJOURNEY IIコンストレインドインサート左 サイズ56/10MM(製品番号:74029262)であることが判明したため、自主回収を実施
することと致しました。
GEヘルス 製造元からの報告により、当該装置の固定台付きカートにおいて、チルト機構
汎用超音波画像診断 ケア・ジャ の不具合により、装置がカートから落下する可能性のあることが分かりまし
た。このため、製造元の情報を基に、お客様に情報提供を行うことで注意喚
装置
パン株式 起を実施し、問題が修正されたチルト機構の部品に交換する改修作業を実施
会社 します。
15/34