よむ、つかう、まなぶ。
資料4-2 令和5年度医療機器・再生医療等製品の自主回収一覧[2.0MB] (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41653.html |
| 出典情報 | 薬事審議会 医療機器・再生医療等製品安全対策部会(令和6年度第1回 8/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
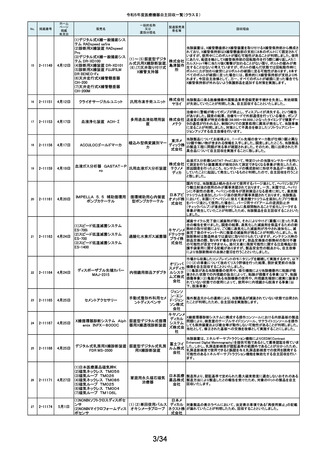
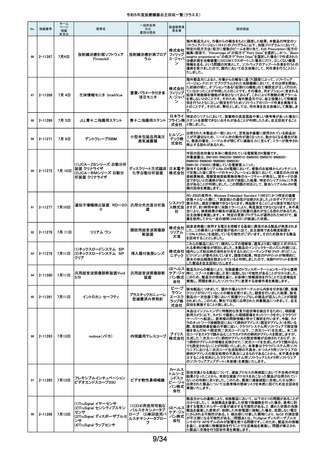
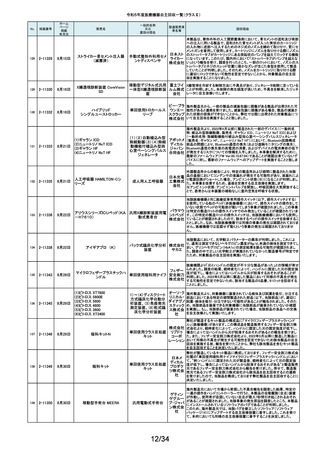
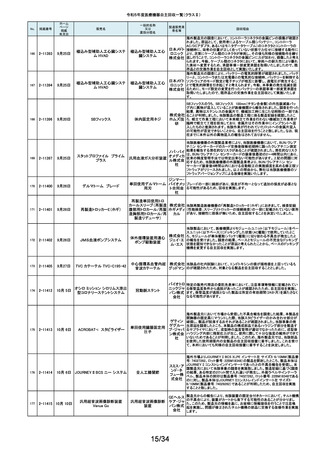
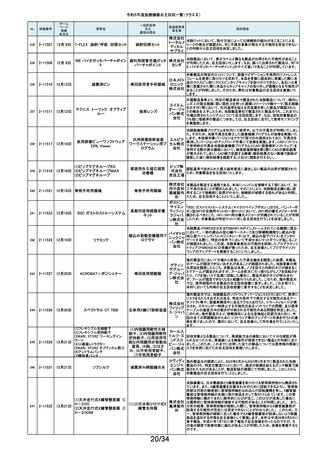
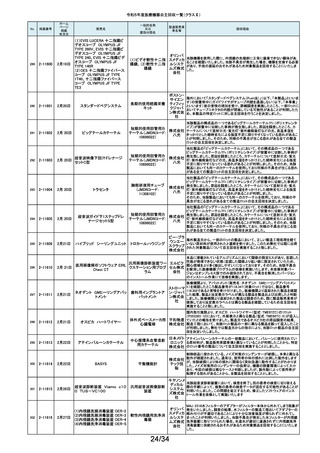
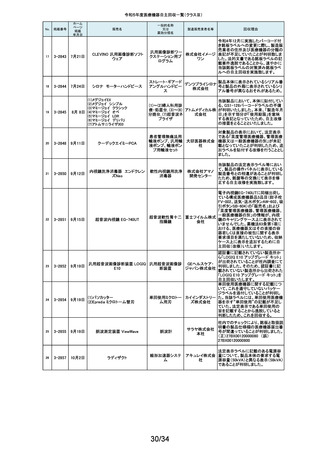
令和5年度医療機器自主回収一覧(クラスⅡ)
No.
掲載番号
ホーム
ページ
掲載
年月日
販売名
一般的名称
又は
薬効分類名
製造販売業
者名等
回収理由
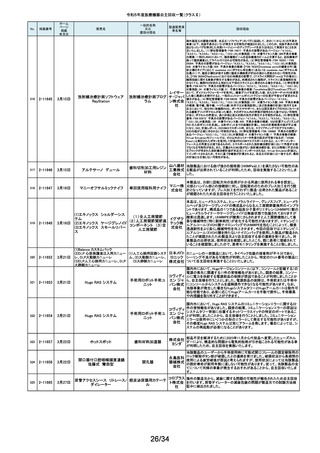
128
2-11329
8月15日
ストライカー骨セメント注入器
(滅菌済)
本製品は、整形外科の人工関節置換術において、骨セメントの混和及び術部
への注入に用いる製品で、混和された骨セメントが入った筒状のカートリッジ
の入れ物に述部へ注入するためのネジ式のノズルを締めて取り付け、更にセ
メントガンを着用して使用します。カートリッジにノズルを取り付ける際にノズル
日本スト のストッパータブがカートリッジにある突起状のバンプを超えてロックする機能
手動式整形外科用セメ
ライカー になっています。このたび、国内外において「ストッパータブがバンプを超えな
ントディスペンサ
株式会社 い」という報告を受け、調査を行ったところ、一部のロットにおいて、ノズルのス
トッパータブとネジのスレッド位置に僅かなズレが生じた金型を使用して製造
していたことが判明しました。そのため、ノズルをカートリッジに取り付ける際
に適切にロックできない可能性を否定できないことから、対象製品の自主回
収を実施することになりました。
129
2-11330
8月16日
X線透視診断装置 CoreVision
SD
移動型デジタル式汎用 富士フイ X線管球を冷却する制御方法に不具合があり、ジェネレータ故障に至っている
一体型X線透視診断装 ルム株式 ことが判明しました。本故障の発生頻度が高いため、不具合を解消したジェネ
置
会社 レータに自主改修いたします。
130
2-11332
8月16日
ハイブリッド
シングルユーストロッカー
ビー・ブラ 海外製造元から、一部の製品の滅菌包装に損傷がある製品が出荷された可
単回使用トロカールス ウンエー 能性があると連絡を受けました。滅菌包装に損傷がある場合、製品の滅菌さ
リーブ
スクラップ れた状態の担保ができないことから、弊社では既に出荷された対象製品につ
株式会社 いて自主回収を実施することと致しました。
131
2-11333
8月21日
(1)ギャラン ICD
(2)ニュートリノ NxT ICD
(3)ギャラン HF
(4)ニュートリノ NxT HF
8月21日
人工呼吸器 HAMILTON-Cシ
リーズ
海外製造元より、2022年4月以前に製造された一部のデバイス((一般的名
称:植込み型除細動器、販売名:ギャラン ICD、ニュートリノ NxT ICD)および
(一般的名称:除細動機能付植込み型両心室ペーシングパルスジェネレータ
(1)(2)自動植込み型
アボットメ (販売名:ギャラン HF、ニュートリノ NxT HF))において、Bluetooth回路構成
除細動器(3)(4)除細
ディカル 部品の問題により、Bluetooth通信の喪失(および遠隔モニタリングの喪失)、
動機能付植込み型両
ジャパン Bluetooth通信の喪失後の高電流の消費、およびデバイスの電池寿命の低下
心室ペーシングパルス
合同会社 が発生するリスクについての情報を入手しました。本事象を解消するために、
ジェネレータ
最新のファームウェア(FW Ver.00.10.87.04)であることが確認出来ていないデ
バイスに対し、最新のファームウェアへのアップデートを実施することと致しま
した。
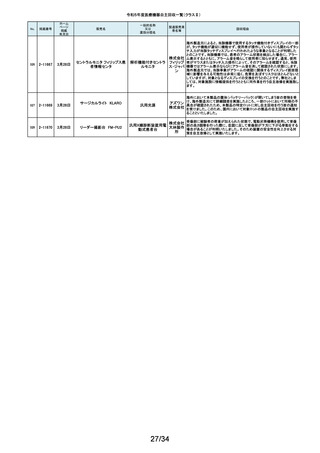
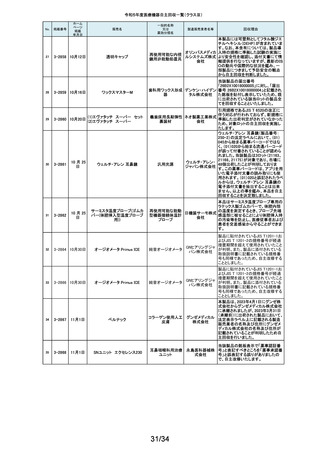
外国製造所からの報告により、特定の製造所および期間に製造された当該
132
2-11335
成人用人工呼吸器
日本光電 品の基板においてコンデンサの液漏れが発生する可能性があり、液漏れによ
り電源回路がショートした場合、アンビエント状態(※)になることが判明しまし
工業株式 た。本事象を改善するため、基板を交換する自主改修を実施します。
会社 ※アンビエント状態:アンビエントバルブを開放し、呼吸回路を大気開放するこ
とで、患者さんは本装置の補助なしに室内空気を呼吸する状態。
133
2-11336
8月22日
当該医療機器と同じ医療従事者用操作スイッチ(以下、操作スイッチとする)
を使用している他のベッド(非医療機器)において、操作スイッチの操作をして
いない状態でベッドの可動部が動いてしまう事象が確認されました。この事象
パラマウ は特定の製造ロットの操作スイッチでのみ発生していることが確認されていま
アリウスシリーズICUベッド(KA 汎用X線診断装置用電
ントベッド す。この特定の製造ロットの操作スイッチは、当該医療機器においても使用し
-H7610)
動式患者台
株式会社 ていることが確認されましたので、該当するベッドの操作スイッチを改修するこ
ととしました。なお、当該医療機器では同様の事象の発生は確認されておりま
せん。医療機器では意図せず動くという事象の発生は確認されておりませ
ん。
8月22日
パック式臨床化学分析 株式会社 り、通常は測定できないヘモグロビン濃度が8g/dL未満の検体を測定できてし
まい、グリコヘモグロビン(HbA1c)の測定結果を誤る可能性が確認されまし
装置
サカエ た。調査の中で正しい光学較正が実施されていなかった製造番号が特定でき
当該製品において、光学較正パラメーターの異常が判明しました。これによ
134
2-11338
アイギアプロ (K)
たため、対象製品の自主回収を実施いたします。
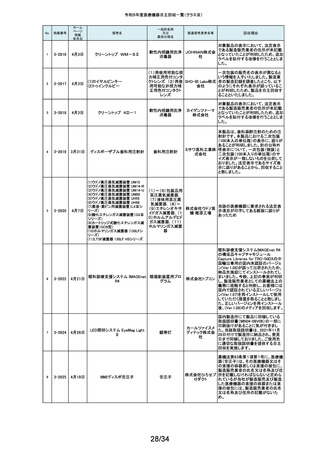
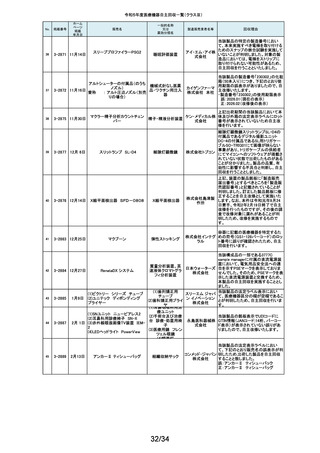
医療機関より「刃とハンドルの固定が不十分な製品があった」との情報が寄せ
135
2-11343
8月28日
フェザー られました。調査の結果、経時変化によって、ハンドルに固定した刃の固定強
マイクロフェザープラスチックハ
度が低下し、場合によってはハンドルから刃が脱落するおそれがあることが
単回使用眼科用ナイフ 安全剃刀 判明しました。2022年5月以降に製造した製品において同様の不具合が発生
ンドル
株式会社 する可能性を否定できないため、該当する製品の5品番、61ロットを回収する
こととしました。
136
2-11345
8月29日
(1)ビトロス XT7600
(2)ビトロス 5600II
(3)ビトロス 5600
(4)ビトロス 4600
(5)ビトロス 3600
(6)ビトロス XT3400
1)~(4)ディスクリート
方式臨床化学自動分
析装置、(5)免疫発光
測定装置、(6)乾式臨
床化学分析装置
オーソ・ク 海外製造元より、対象機器に装着されている検体及び試薬を吸引、分注する
リニカル・ 部品においてある特定の期間製造された部品(以下、当該部品)が、適切に
ダイアグノ 試薬・検体を吸引・分注できない可能性があることが報告されました。そのた
スティック め、当該部品を装着できる対象機器に当該部品が装着されていないか確認
ス株式会 を実施し、もし、当該部品が装着されていた場合、当該部品の良品への交換
を自主改修として実施いたします。
社
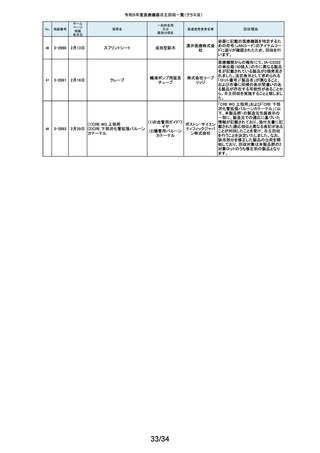
弊社が製造するキット製品の構成品に「マイクロフェザープラスチックハンド
ル」(医療機器)があります。この構成品を製造販売するフェザー安全剃刀株
137
138
2-11346
2-11349
8月29日
8月30日
眼科キットN
眼科キット
株式会社 式会社より、経時変化によって、ハンドルに固定した刃の固定強度が低下し、
単回使用クラスⅢ処置 リブドゥ 場合によってはハンドルから刃が脱落するおそれがあるとの報告を受けまし
キット
コーポ た。また、フェザー安全剃刀株式会社より、2022年5月以降に製造した製品に
レーション おいて同様の不具合が発生する可能性を否定できないため該当製品の自主
回収を実施する旨、報告を受けたことから、弊社も該当製品を含むキット製品
を自主回収することを決定いたしました。
弊社が製造しているキット製品に構成しております、フェザー安全剃刀株式会
日本メ 社製の「単回使用眼科用ナイフマイクロフェザープラスチックハンドル」におい
ディカル て、“柄(ハンドル)に固定された刃が製造後、経時変化によって刃の固定強
単回使用クラスⅢ処置
度が低下し、場合によってはハンドルから脱落するおそれがある”と製造販売
プロダク 元であるフェザー安全剃刀株式会社から報告を受けました。併せて、製造販
キット
ツ株式会 売元であるフェザー安全剃刀株式会社から該当品を自主回収するとの連絡
社
を受けましたので、当該品を構成しております弊社製品を自主回収することに
決定いたしました。
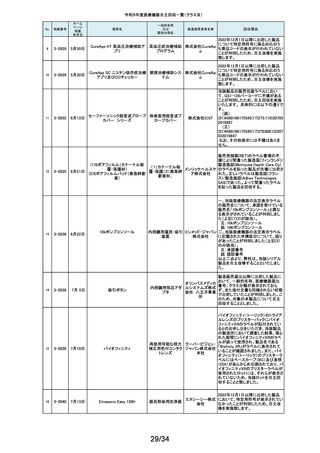
海外製造元において市場から受領した不具合報告を調査した結果、特定の
139
2-11350
8月30日
移動型手術台 MEERA
汎用電動式手術台
ゲティン 一連の操作をハンドコントローラ―で行うと、本製品の自動駆動(自走)装置
ゲグルー が作動し、使用者が意図していない自走が最大7秒間引き起こされるおそれ
があることが確認されました。当該事象の発生原因を調査したところ、本製品
プ・ジャパ にインストールされているソフトウェアのバグであることが判明しました。
ン株式会 このため、海外製造元では、当該バグを修正したソフトウェア(ソフトウェア
社
パッケージ14)にアップデートする自主改修措置に着手しました。これを受け
て、本邦においても同様の自主改修措置に着手することを決定しました。
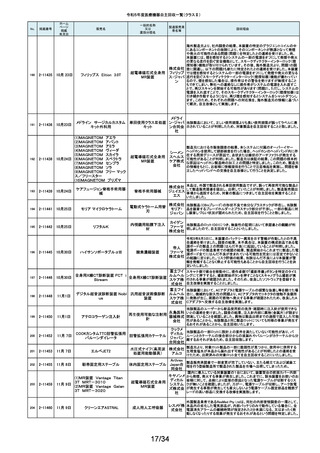
12/34
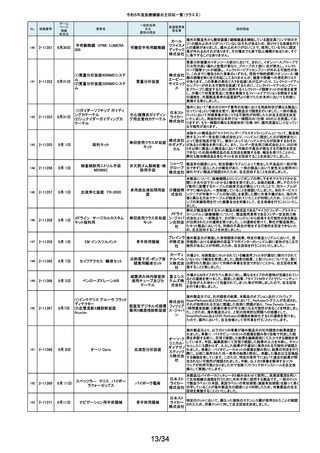
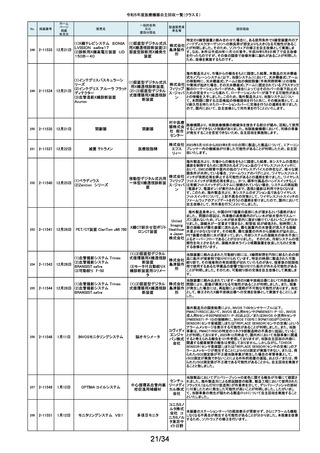
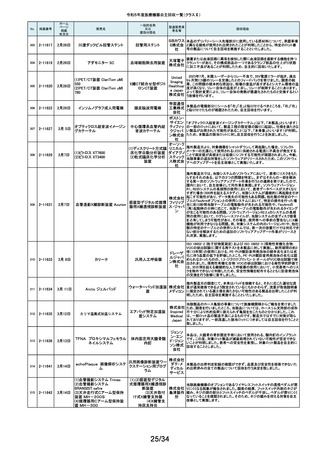
No.
掲載番号
ホーム
ページ
掲載
年月日
販売名
一般的名称
又は
薬効分類名
製造販売業
者名等
回収理由
128
2-11329
8月15日
ストライカー骨セメント注入器
(滅菌済)
本製品は、整形外科の人工関節置換術において、骨セメントの混和及び術部
への注入に用いる製品で、混和された骨セメントが入った筒状のカートリッジ
の入れ物に述部へ注入するためのネジ式のノズルを締めて取り付け、更にセ
メントガンを着用して使用します。カートリッジにノズルを取り付ける際にノズル
日本スト のストッパータブがカートリッジにある突起状のバンプを超えてロックする機能
手動式整形外科用セメ
ライカー になっています。このたび、国内外において「ストッパータブがバンプを超えな
ントディスペンサ
株式会社 い」という報告を受け、調査を行ったところ、一部のロットにおいて、ノズルのス
トッパータブとネジのスレッド位置に僅かなズレが生じた金型を使用して製造
していたことが判明しました。そのため、ノズルをカートリッジに取り付ける際
に適切にロックできない可能性を否定できないことから、対象製品の自主回
収を実施することになりました。
129
2-11330
8月16日
X線透視診断装置 CoreVision
SD
移動型デジタル式汎用 富士フイ X線管球を冷却する制御方法に不具合があり、ジェネレータ故障に至っている
一体型X線透視診断装 ルム株式 ことが判明しました。本故障の発生頻度が高いため、不具合を解消したジェネ
置
会社 レータに自主改修いたします。
130
2-11332
8月16日
ハイブリッド
シングルユーストロッカー
ビー・ブラ 海外製造元から、一部の製品の滅菌包装に損傷がある製品が出荷された可
単回使用トロカールス ウンエー 能性があると連絡を受けました。滅菌包装に損傷がある場合、製品の滅菌さ
リーブ
スクラップ れた状態の担保ができないことから、弊社では既に出荷された対象製品につ
株式会社 いて自主回収を実施することと致しました。
131
2-11333
8月21日
(1)ギャラン ICD
(2)ニュートリノ NxT ICD
(3)ギャラン HF
(4)ニュートリノ NxT HF
8月21日
人工呼吸器 HAMILTON-Cシ
リーズ
海外製造元より、2022年4月以前に製造された一部のデバイス((一般的名
称:植込み型除細動器、販売名:ギャラン ICD、ニュートリノ NxT ICD)および
(一般的名称:除細動機能付植込み型両心室ペーシングパルスジェネレータ
(1)(2)自動植込み型
アボットメ (販売名:ギャラン HF、ニュートリノ NxT HF))において、Bluetooth回路構成
除細動器(3)(4)除細
ディカル 部品の問題により、Bluetooth通信の喪失(および遠隔モニタリングの喪失)、
動機能付植込み型両
ジャパン Bluetooth通信の喪失後の高電流の消費、およびデバイスの電池寿命の低下
心室ペーシングパルス
合同会社 が発生するリスクについての情報を入手しました。本事象を解消するために、
ジェネレータ
最新のファームウェア(FW Ver.00.10.87.04)であることが確認出来ていないデ
バイスに対し、最新のファームウェアへのアップデートを実施することと致しま
した。
外国製造所からの報告により、特定の製造所および期間に製造された当該
132
2-11335
成人用人工呼吸器
日本光電 品の基板においてコンデンサの液漏れが発生する可能性があり、液漏れによ
り電源回路がショートした場合、アンビエント状態(※)になることが判明しまし
工業株式 た。本事象を改善するため、基板を交換する自主改修を実施します。
会社 ※アンビエント状態:アンビエントバルブを開放し、呼吸回路を大気開放するこ
とで、患者さんは本装置の補助なしに室内空気を呼吸する状態。
133
2-11336
8月22日
当該医療機器と同じ医療従事者用操作スイッチ(以下、操作スイッチとする)
を使用している他のベッド(非医療機器)において、操作スイッチの操作をして
いない状態でベッドの可動部が動いてしまう事象が確認されました。この事象
パラマウ は特定の製造ロットの操作スイッチでのみ発生していることが確認されていま
アリウスシリーズICUベッド(KA 汎用X線診断装置用電
ントベッド す。この特定の製造ロットの操作スイッチは、当該医療機器においても使用し
-H7610)
動式患者台
株式会社 ていることが確認されましたので、該当するベッドの操作スイッチを改修するこ
ととしました。なお、当該医療機器では同様の事象の発生は確認されておりま
せん。医療機器では意図せず動くという事象の発生は確認されておりませ
ん。
8月22日
パック式臨床化学分析 株式会社 り、通常は測定できないヘモグロビン濃度が8g/dL未満の検体を測定できてし
まい、グリコヘモグロビン(HbA1c)の測定結果を誤る可能性が確認されまし
装置
サカエ た。調査の中で正しい光学較正が実施されていなかった製造番号が特定でき
当該製品において、光学較正パラメーターの異常が判明しました。これによ
134
2-11338
アイギアプロ (K)
たため、対象製品の自主回収を実施いたします。
医療機関より「刃とハンドルの固定が不十分な製品があった」との情報が寄せ
135
2-11343
8月28日
フェザー られました。調査の結果、経時変化によって、ハンドルに固定した刃の固定強
マイクロフェザープラスチックハ
度が低下し、場合によってはハンドルから刃が脱落するおそれがあることが
単回使用眼科用ナイフ 安全剃刀 判明しました。2022年5月以降に製造した製品において同様の不具合が発生
ンドル
株式会社 する可能性を否定できないため、該当する製品の5品番、61ロットを回収する
こととしました。
136
2-11345
8月29日
(1)ビトロス XT7600
(2)ビトロス 5600II
(3)ビトロス 5600
(4)ビトロス 4600
(5)ビトロス 3600
(6)ビトロス XT3400
1)~(4)ディスクリート
方式臨床化学自動分
析装置、(5)免疫発光
測定装置、(6)乾式臨
床化学分析装置
オーソ・ク 海外製造元より、対象機器に装着されている検体及び試薬を吸引、分注する
リニカル・ 部品においてある特定の期間製造された部品(以下、当該部品)が、適切に
ダイアグノ 試薬・検体を吸引・分注できない可能性があることが報告されました。そのた
スティック め、当該部品を装着できる対象機器に当該部品が装着されていないか確認
ス株式会 を実施し、もし、当該部品が装着されていた場合、当該部品の良品への交換
を自主改修として実施いたします。
社
弊社が製造するキット製品の構成品に「マイクロフェザープラスチックハンド
ル」(医療機器)があります。この構成品を製造販売するフェザー安全剃刀株
137
138
2-11346
2-11349
8月29日
8月30日
眼科キットN
眼科キット
株式会社 式会社より、経時変化によって、ハンドルに固定した刃の固定強度が低下し、
単回使用クラスⅢ処置 リブドゥ 場合によってはハンドルから刃が脱落するおそれがあるとの報告を受けまし
キット
コーポ た。また、フェザー安全剃刀株式会社より、2022年5月以降に製造した製品に
レーション おいて同様の不具合が発生する可能性を否定できないため該当製品の自主
回収を実施する旨、報告を受けたことから、弊社も該当製品を含むキット製品
を自主回収することを決定いたしました。
弊社が製造しているキット製品に構成しております、フェザー安全剃刀株式会
日本メ 社製の「単回使用眼科用ナイフマイクロフェザープラスチックハンドル」におい
ディカル て、“柄(ハンドル)に固定された刃が製造後、経時変化によって刃の固定強
単回使用クラスⅢ処置
度が低下し、場合によってはハンドルから脱落するおそれがある”と製造販売
プロダク 元であるフェザー安全剃刀株式会社から報告を受けました。併せて、製造販
キット
ツ株式会 売元であるフェザー安全剃刀株式会社から該当品を自主回収するとの連絡
社
を受けましたので、当該品を構成しております弊社製品を自主回収することに
決定いたしました。
海外製造元において市場から受領した不具合報告を調査した結果、特定の
139
2-11350
8月30日
移動型手術台 MEERA
汎用電動式手術台
ゲティン 一連の操作をハンドコントローラ―で行うと、本製品の自動駆動(自走)装置
ゲグルー が作動し、使用者が意図していない自走が最大7秒間引き起こされるおそれ
があることが確認されました。当該事象の発生原因を調査したところ、本製品
プ・ジャパ にインストールされているソフトウェアのバグであることが判明しました。
ン株式会 このため、海外製造元では、当該バグを修正したソフトウェア(ソフトウェア
社
パッケージ14)にアップデートする自主改修措置に着手しました。これを受け
て、本邦においても同様の自主改修措置に着手することを決定しました。
12/34