よむ、つかう、まなぶ。
資料4-2 令和5年度医療機器・再生医療等製品の自主回収一覧[2.0MB] (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41653.html |
| 出典情報 | 薬事審議会 医療機器・再生医療等製品安全対策部会(令和6年度第1回 8/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
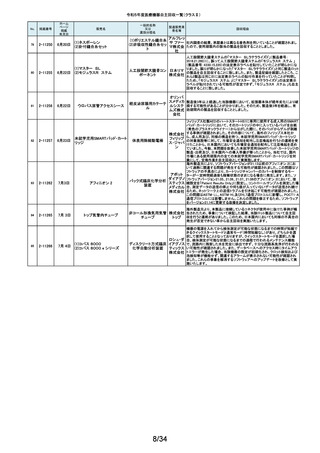
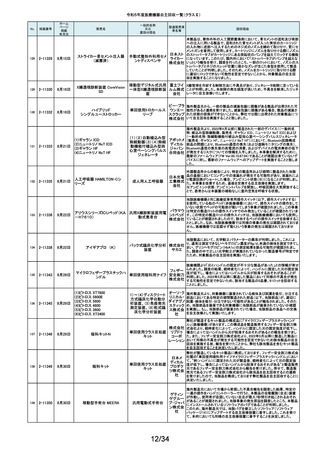
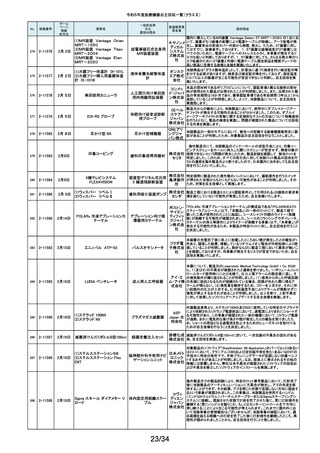
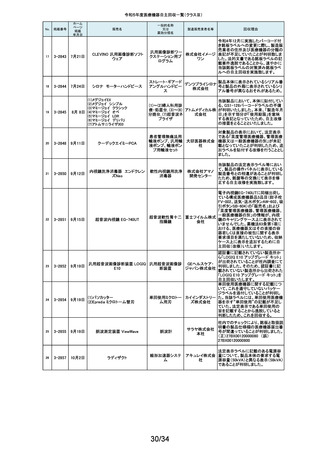
令和5年度医療機器自主回収一覧(クラスⅡ)
ホーム
ページ
掲載
年月日
No.
掲載番号
220
(1)Truliant PS人工膝関節システ
ム
(2)Truliant CR人工膝関節システ
2-11489 11月28日
ム
(3)エキノックス スモールリバー
ス
221
2-11490 11月28日
下肢荷重計 そくまる IS-10
222
2-11491 11月28日
喉頭ファイバースコープ
OLYMPUS LF-GP
223
2-11494 11月29日
224
2-11495 11月30日
225
226
2-11496 11月30日
2-11497
12月1日
販売名
(1)手らくブレスレット
(2)足らくアンクレット
(3)らくらくブレス
(4)サークルZブレスレット
一般的名称
又は
薬効分類名
製造販売業
者名等
回収理由
(1)(2)全人工膝関節
(3)全人工肩関節
本品は人工膝関節置換術用の脛骨インサート及び人工肩関節置換術用の
ヒューメラルライナーであり、超高分子量ポリエチレン(UHMWPE)製です。本
イグザク 製品は、2重の滅菌ボックス内に真空バッグに包まれた状態で包装されており
真空バッグにキズが発見されたため真空度が保証できない可能性があるとし
テック株 て今回製造元より自主回収する旨の連絡を受けました。尚、滅菌ボックスの
式会社 無菌性については何ら問題ありません。対象製品の出荷状況、使用状況を確
認しましたところ、既に患者に埋植されていることを確認致しましたので、患者
モニタリングを実施することと致しました。
歩行分析計
デュプロ 当該製品において、医療機関より靴底が剥がれたとの報告がありました。調
査の結果、異物混入により靴底の接着強度が弱くなっていることが判明し、上
精工株式 記ロットにて同不具合の可能性があることから自主回収(改修)を行うことと致
会社 しました。
軟性喉頭鏡
オリンパ
スメディカ 本製品は、気管チューブの挿管を行う際に用いられます。この度、規定してい
ルシステ る吸引量を満足していない製品が出荷されている可能性が判明したため、対
ムズ株式 象製品を自主回収することとしました。
会社
非能動型接触鍼
株式会社 これらの製品の一般的名称は非能動型接触鍼でありますが、製造販売届書
の内容のうち、使用目的又は効果が一般的名称の定義の範囲を逸脱してい
森口合成 ることを指摘され、自主回収することにいたしました。
HDカメラコントロールユニット
FT-600C
内視鏡ビデオ画像プロ ニスコ株
当該製品の法定表示ラベルの記載事項の誤記による改修
セッサ
式会社
エンドノズル#30(オレンジ)
本品は、根管充填材料を根管へ移送するために使用するためのものです。一
部の医療機関より、エンドノズル#30(オレンジ)を使用する際に、根管充填
サンメディ 材料が吐出しないとの報告を受けました。調査の結果、本品から根管充填材
歯科用充填・修復材補
カル株式 料が吐出しない状態が同様に発生しうることを確認し、医療機器製造販売届
助器具(38782000)
会社 の一部規格を満たさない事が判明しました。今後も同様の事象が発生する可
能性が完全には否定できないため、対象製品の自主回収を実施することとい
たしました。
ID NOW インスツルメント
遺伝子解析装置
当該医療機器ではひとつの患者検体から一度にID NOW 新型コロナウイルス
2019 v2.0(体外診断用医薬品、製造販売承認番号:30400EZX00069000)とID
NOW インフルエンザ A & B 2(体外診断用医薬品、製造販売承認番号:
アボット 30200EZX00009000)を連続して検査することができます。この連続した検査
ダイアグノ 方法を用いた際、一部のお客様からID NOW インフルエンザ A & B 2の検査
スティクス 結果においてB型インフルエンザの偽陽性が報告されました。製造元による
メディカル 調査の結果、ID NOW インフルエンザ A & B 2におけるB型インフルエンザの
株式会社 特異性は、連続した検査を実施した場合でも、要求される製品性能の範囲内
であることが確認されていますが、偽陽性報告が増加傾向にあることを受け、
この発生の可能性を軽減するために、ソフトウェアのバージョンを7.1.4.16へ
アップグレードするための改修を実施することを決定しました。
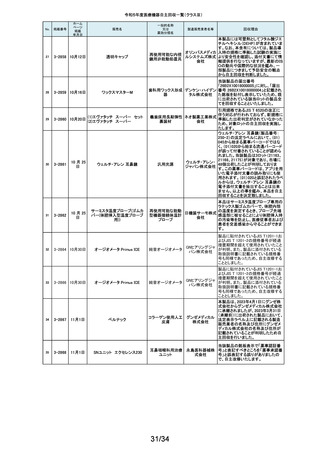
海外製造元の調査により、当該製品群において、電池の設計に起因し、電池
227
2-11498
12月1日
(1)(2) 植込み型心臓
(1) インジェニオ(承認整理済)
ペースメーカ (3) 除細
(2) インジェニオ MRI(承認整理
動機能なし植込み型両
済)
心室ペーシングパルス
(3) インヴァイブ(承認整理済)
ジェネレータ
ボストン・ 寿命後期に製品の電池内部抵抗値が上昇した場合にセーフティモードへ移
サイエン 行する事象(以下、本事象)が発生する可能性が確認されました。当該製品
ティフィッ 群は患者様へ植え込まれているため、当該製品群の出荷履歴のある医療機
関及びフォローアップ実施医療機関に対して、当該製品群が植込まれている
クジャパ 患者様について製品交換を含めた治療方針の確認及び定期的なフォロー
ン株式会 アップの実施をお願いすることといたしました。なお、当該製品群はすでに販
社
売を終了しており、弊社の他の製品においては電池設計が異なるため本事象
が発生する可能性はございません。
228
229
230
231
2-11500
12月4日
食道用バルーンダイレータ
オリンパ
スメディカ 医療機関より、バルーンの拡張不良や収縮不良等の報告がありました。製造
食道用バルーンカテー
ルシステ 元にて調査したところ、カテーテル内腔の加工に問題があった製品を出荷し
テル
ムズ株式 ていた可能性が判明したため、自主回収をいたします。
会社
12月 6日
当該機器の設計開発、製造元である米国のCarestream Health, Inc.より、下
記の故障の可能性について報告があり、米国内にて改修に着手されました。
検討の結果、国内においても同様に改修が必要と判断され、改修に着手しま
ケアスト した。DRX-RevolutionモバイルX線システムに搭載のCommunication & Power
ケアストリーム DRX-Revolution 移動型デジタル式汎用 リームヘ Industries, Inc (CPI)製ジェネレータの電気コンポーネントに、予期せぬ故障が
発生する可能性があります。これは、ジェネレータ内の一時的で、独立した熱
Mobile X-Ray システム
X線診断装置
ルス株式 過負荷につながる可能性があります。このような事態が発生した場合、システ
会社 ムは操作不能となり、大きな音、焦げた臭いおよび煙が発生する可能性があ
ります。今改修により、CPIジェネレーターの信頼性を向上させ、高電圧ケーブ
ルと、ジェネレーター回路間の絶縁性を改善し、より熱対策を向上させます。
これにより、不用意なショートによる熱事象の発生を防ぐ事が期待されます。
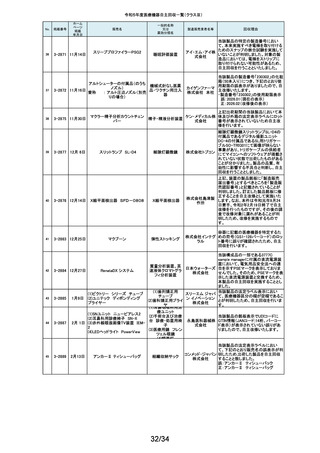
2-11503
12月 7日
CTスキャナ Aquilion Serve
TSX-307A
全身用X線CT診断装
置
キヤノンメ 当該装置において、特定の撮影条件において、誤った線量表示用計算パラ
ディカル メータを基に線量表示を行うことが判明しました。この場合、画面に表示され
システム る線量表示値は、表示すべき線量表示値より低く表示されます。この問題を
ズ株式会 是正するため、線量表示用計算パラメータを修正するソフトウェアの対策を改
修として実施いたします。
社
2-11504
(1)MR装置 Vantage Orian
MRT-1550
(2)MR装置 Vantage Elan
12月 7日
MRT-2020
(3)MR装置 Vantage Titan
MRT-2004
超電導磁石式全身用
MR装置
キヤノンメ 最大空間勾配磁場(最大SFG)の画面表示値とマニュアルに記載した値が、
ディカル 設計値と異なる事が判明しました。MR適合デバイスを体内に持つ患者を撮影
システム する際、顧客が撮像可否の判断を誤る可能性があるため、画面表示値を修
ズ株式会 正したソフトウェアのリリースと、修正したマニュアルへ差替えを改修として実
施します。
社
12月 7日
単回使用組織生検用 株式会社 ない、または、外筒針の内径が仕様よりも太いあるいはニードル長が長いた
針
メディコン めに生検針が外筒針に適合せず、組織生検を実施できない可能性があるこ
2-11502
海外製造元の調査にて、キット内に異なるサイズの外筒針(コアキシャルニー
ドル)が同梱され、外筒針の内径が仕様よりも細いために生検針が挿入でき
232
2-11505
MISSION コアニードル
とが判明したため、対象製造番号の製品の自主回収を実施することといたし
ました。
233
2-11506
12月 7日
シャーロック3CGプラス
中心静脈カテーテル留
株式会社 対象製品において、主たる構成品であるモニターの型(バージョン)が承認書
に記載された型より古いものであることが判明したため、自主回収を実施する
置用ナビゲーション装
メディコン ことといたしました。
置
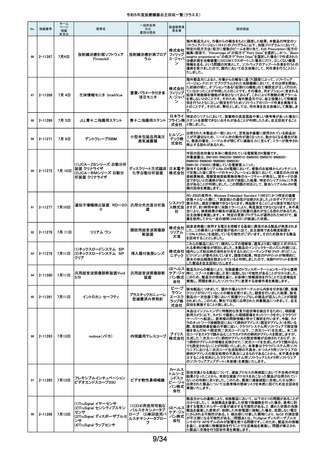
19/34
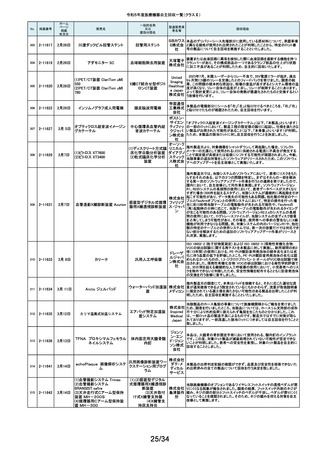
ホーム
ページ
掲載
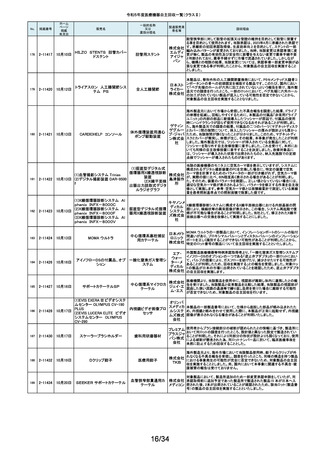
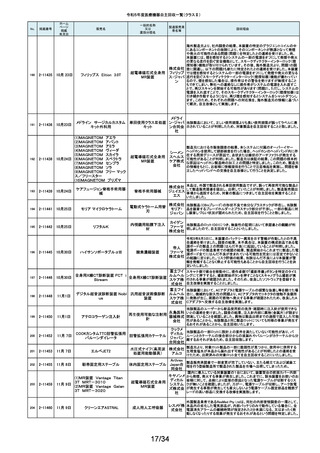
年月日
No.
掲載番号
220
(1)Truliant PS人工膝関節システ
ム
(2)Truliant CR人工膝関節システ
2-11489 11月28日
ム
(3)エキノックス スモールリバー
ス
221
2-11490 11月28日
下肢荷重計 そくまる IS-10
222
2-11491 11月28日
喉頭ファイバースコープ
OLYMPUS LF-GP
223
2-11494 11月29日
224
2-11495 11月30日
225
226
2-11496 11月30日
2-11497
12月1日
販売名
(1)手らくブレスレット
(2)足らくアンクレット
(3)らくらくブレス
(4)サークルZブレスレット
一般的名称
又は
薬効分類名
製造販売業
者名等
回収理由
(1)(2)全人工膝関節
(3)全人工肩関節
本品は人工膝関節置換術用の脛骨インサート及び人工肩関節置換術用の
ヒューメラルライナーであり、超高分子量ポリエチレン(UHMWPE)製です。本
イグザク 製品は、2重の滅菌ボックス内に真空バッグに包まれた状態で包装されており
真空バッグにキズが発見されたため真空度が保証できない可能性があるとし
テック株 て今回製造元より自主回収する旨の連絡を受けました。尚、滅菌ボックスの
式会社 無菌性については何ら問題ありません。対象製品の出荷状況、使用状況を確
認しましたところ、既に患者に埋植されていることを確認致しましたので、患者
モニタリングを実施することと致しました。
歩行分析計
デュプロ 当該製品において、医療機関より靴底が剥がれたとの報告がありました。調
査の結果、異物混入により靴底の接着強度が弱くなっていることが判明し、上
精工株式 記ロットにて同不具合の可能性があることから自主回収(改修)を行うことと致
会社 しました。
軟性喉頭鏡
オリンパ
スメディカ 本製品は、気管チューブの挿管を行う際に用いられます。この度、規定してい
ルシステ る吸引量を満足していない製品が出荷されている可能性が判明したため、対
ムズ株式 象製品を自主回収することとしました。
会社
非能動型接触鍼
株式会社 これらの製品の一般的名称は非能動型接触鍼でありますが、製造販売届書
の内容のうち、使用目的又は効果が一般的名称の定義の範囲を逸脱してい
森口合成 ることを指摘され、自主回収することにいたしました。
HDカメラコントロールユニット
FT-600C
内視鏡ビデオ画像プロ ニスコ株
当該製品の法定表示ラベルの記載事項の誤記による改修
セッサ
式会社
エンドノズル#30(オレンジ)
本品は、根管充填材料を根管へ移送するために使用するためのものです。一
部の医療機関より、エンドノズル#30(オレンジ)を使用する際に、根管充填
サンメディ 材料が吐出しないとの報告を受けました。調査の結果、本品から根管充填材
歯科用充填・修復材補
カル株式 料が吐出しない状態が同様に発生しうることを確認し、医療機器製造販売届
助器具(38782000)
会社 の一部規格を満たさない事が判明しました。今後も同様の事象が発生する可
能性が完全には否定できないため、対象製品の自主回収を実施することとい
たしました。
ID NOW インスツルメント
遺伝子解析装置
当該医療機器ではひとつの患者検体から一度にID NOW 新型コロナウイルス
2019 v2.0(体外診断用医薬品、製造販売承認番号:30400EZX00069000)とID
NOW インフルエンザ A & B 2(体外診断用医薬品、製造販売承認番号:
アボット 30200EZX00009000)を連続して検査することができます。この連続した検査
ダイアグノ 方法を用いた際、一部のお客様からID NOW インフルエンザ A & B 2の検査
スティクス 結果においてB型インフルエンザの偽陽性が報告されました。製造元による
メディカル 調査の結果、ID NOW インフルエンザ A & B 2におけるB型インフルエンザの
株式会社 特異性は、連続した検査を実施した場合でも、要求される製品性能の範囲内
であることが確認されていますが、偽陽性報告が増加傾向にあることを受け、
この発生の可能性を軽減するために、ソフトウェアのバージョンを7.1.4.16へ
アップグレードするための改修を実施することを決定しました。
海外製造元の調査により、当該製品群において、電池の設計に起因し、電池
227
2-11498
12月1日
(1)(2) 植込み型心臓
(1) インジェニオ(承認整理済)
ペースメーカ (3) 除細
(2) インジェニオ MRI(承認整理
動機能なし植込み型両
済)
心室ペーシングパルス
(3) インヴァイブ(承認整理済)
ジェネレータ
ボストン・ 寿命後期に製品の電池内部抵抗値が上昇した場合にセーフティモードへ移
サイエン 行する事象(以下、本事象)が発生する可能性が確認されました。当該製品
ティフィッ 群は患者様へ植え込まれているため、当該製品群の出荷履歴のある医療機
関及びフォローアップ実施医療機関に対して、当該製品群が植込まれている
クジャパ 患者様について製品交換を含めた治療方針の確認及び定期的なフォロー
ン株式会 アップの実施をお願いすることといたしました。なお、当該製品群はすでに販
社
売を終了しており、弊社の他の製品においては電池設計が異なるため本事象
が発生する可能性はございません。
228
229
230
231
2-11500
12月4日
食道用バルーンダイレータ
オリンパ
スメディカ 医療機関より、バルーンの拡張不良や収縮不良等の報告がありました。製造
食道用バルーンカテー
ルシステ 元にて調査したところ、カテーテル内腔の加工に問題があった製品を出荷し
テル
ムズ株式 ていた可能性が判明したため、自主回収をいたします。
会社
12月 6日
当該機器の設計開発、製造元である米国のCarestream Health, Inc.より、下
記の故障の可能性について報告があり、米国内にて改修に着手されました。
検討の結果、国内においても同様に改修が必要と判断され、改修に着手しま
ケアスト した。DRX-RevolutionモバイルX線システムに搭載のCommunication & Power
ケアストリーム DRX-Revolution 移動型デジタル式汎用 リームヘ Industries, Inc (CPI)製ジェネレータの電気コンポーネントに、予期せぬ故障が
発生する可能性があります。これは、ジェネレータ内の一時的で、独立した熱
Mobile X-Ray システム
X線診断装置
ルス株式 過負荷につながる可能性があります。このような事態が発生した場合、システ
会社 ムは操作不能となり、大きな音、焦げた臭いおよび煙が発生する可能性があ
ります。今改修により、CPIジェネレーターの信頼性を向上させ、高電圧ケーブ
ルと、ジェネレーター回路間の絶縁性を改善し、より熱対策を向上させます。
これにより、不用意なショートによる熱事象の発生を防ぐ事が期待されます。
2-11503
12月 7日
CTスキャナ Aquilion Serve
TSX-307A
全身用X線CT診断装
置
キヤノンメ 当該装置において、特定の撮影条件において、誤った線量表示用計算パラ
ディカル メータを基に線量表示を行うことが判明しました。この場合、画面に表示され
システム る線量表示値は、表示すべき線量表示値より低く表示されます。この問題を
ズ株式会 是正するため、線量表示用計算パラメータを修正するソフトウェアの対策を改
修として実施いたします。
社
2-11504
(1)MR装置 Vantage Orian
MRT-1550
(2)MR装置 Vantage Elan
12月 7日
MRT-2020
(3)MR装置 Vantage Titan
MRT-2004
超電導磁石式全身用
MR装置
キヤノンメ 最大空間勾配磁場(最大SFG)の画面表示値とマニュアルに記載した値が、
ディカル 設計値と異なる事が判明しました。MR適合デバイスを体内に持つ患者を撮影
システム する際、顧客が撮像可否の判断を誤る可能性があるため、画面表示値を修
ズ株式会 正したソフトウェアのリリースと、修正したマニュアルへ差替えを改修として実
施します。
社
12月 7日
単回使用組織生検用 株式会社 ない、または、外筒針の内径が仕様よりも太いあるいはニードル長が長いた
針
メディコン めに生検針が外筒針に適合せず、組織生検を実施できない可能性があるこ
2-11502
海外製造元の調査にて、キット内に異なるサイズの外筒針(コアキシャルニー
ドル)が同梱され、外筒針の内径が仕様よりも細いために生検針が挿入でき
232
2-11505
MISSION コアニードル
とが判明したため、対象製造番号の製品の自主回収を実施することといたし
ました。
233
2-11506
12月 7日
シャーロック3CGプラス
中心静脈カテーテル留
株式会社 対象製品において、主たる構成品であるモニターの型(バージョン)が承認書
に記載された型より古いものであることが判明したため、自主回収を実施する
置用ナビゲーション装
メディコン ことといたしました。
置
19/34