よむ、つかう、まなぶ。
資料4-2 令和5年度医療機器・再生医療等製品の自主回収一覧[2.0MB] (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41653.html |
| 出典情報 | 薬事審議会 医療機器・再生医療等製品安全対策部会(令和6年度第1回 8/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
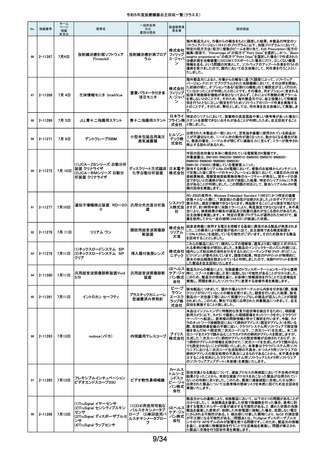
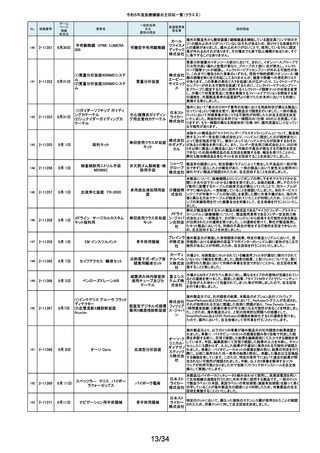
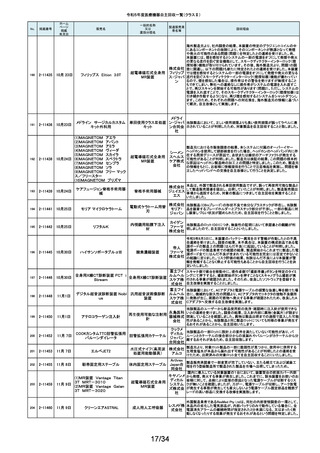
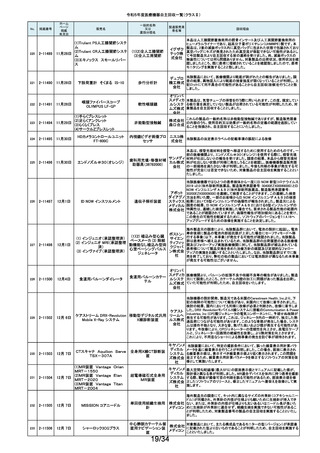
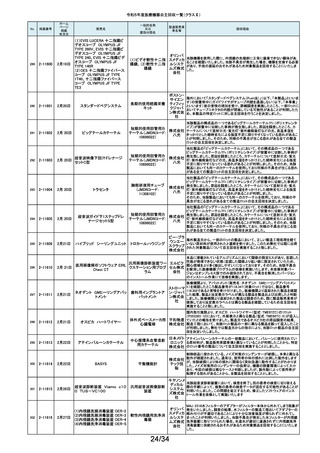
令和5年度医療機器自主回収一覧(クラスⅡ)
No.
掲載番号
ホーム
ページ
掲載
年月日
販売名
一般的名称
又は
薬効分類名
製造販売業
者名等
回収理由
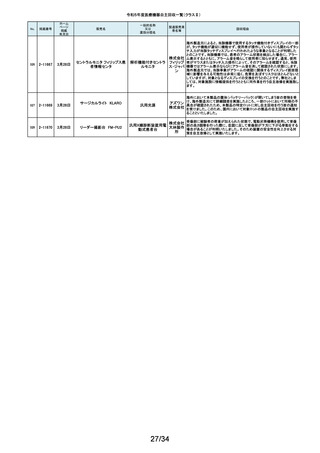
154
2-11372
9月11日
EnSite X EPシステム
国内外の医療機関より、ソフトウェアバージョン3.0がインストールされたEnsite
X EPシステムとTactiFlex SEイリゲーションカテーテルを使用した際、ベクトル
アロー及びディフレクションインジケーターの向きが90度ずれて表示されると
アボットメ の報告を受領しました。調査の結果、バージョン3.0のソフトウェアと一部の
心臓カテーテル用検査 ディカル TactiFlex SEイリゲーションカテーテルに使用している構成部品との間に、互
換性の問題があることがわかりました。バージョン2.0.1以下のソフトウェアをイ
装置
ジャパン ンストールしたEnsite X EPシステム及びTactiFlex SEイリゲーションカテーテ
合同会社 ル以外のカテーテルに当該問題は生じません。この問題を解決するため、
バージョン3.0のソフトウェアがインストールされたEnsite X EPシステムを、修
正されたソフトウェア(バージョン3.0.1)にアップグレードするための自主改修を
行います。
155
2-11374
9月12日
レトロ用ドリルシステム
Arthrex
単回使用手術用ドリル
製造販売認証書に記載されていない登録製造所において製造されていた製
Japan合 品が出荷されていたことが確認されたため。
アタッチメント
同会社
9月13日
テルフュージョンポンプ用輸液
セット
医療機関から、テルフュージョンポンプ用輸液セットについて、使用中に
チューブとロックコネクターとの接合部から液漏れ、またはチューブからロック
輸液ポンプ用輸液セッ テルモ株 コネクターが外れたとの品質情報を受け付けました。詳細に調査した結果、
チューブとロックコネクターの接合力を保持するための前処理工程が未実施
ト
式会社 であった製品が誤って出荷されていることが判明しました。出荷済み製品に同
様の状態の製品が一部含まれている可能性があることから、自主回収を実施
することとしました。
9月13日
ボストン・ S-ICDパルスジェネレータ(承認番号:22700BZX00132000)(以下、S-ICD)と
サイエン ラティチュード Wave コミュニケータ(認証番号: 226ADBZX00186000)(以下、
(1)S-ICDプログラマ
植込み能動型機器用プ ティフィッ 遠隔モニタリングシステム)の通信時においてごく稀にセンシングが無効にな
(2)ラティチュード プログラミング
ログラマ
クジャパ る事象が発生することが判明しました。この事象は24時間後に自動的に復旧
システム 3300
ン株式会 しますが、本改修により、この事象が発生した場合でも1心周期後にセンシン
グが再開するようになります。
社
9月14日
本品は、頭蓋顎顔面領域における、骨奇形や骨折治療時に骨折間隙を埋
め、骨折部位を応力から保護するため、骨折片に取付けるプレート製品で
す。この度、当該製品の外箱に貼付されている製造元ラベルにあるカラーラ
ジョンソ ベル※1が、本来であれば厚さ0.8mmを示す「赤色」でなければならないとこ
ン・エン ろ、厚さ1.2mmを示す「青色」のカラーラベルが貼付されている製品が確認さ
ド・ジョン れました。国内在庫を確認したところ、対象ロット製品において、同様事象が
ソン株式 発生していることが判明しました。また、ラベルに記載のスクリュー長と中身の
会社 製品のスクリュー長は同じであり、カラーラベルの情報だけが間違っているこ
とが分かっています。患者様への安全性を重視し、対象製品を自主的に回収
することとしました。※1:カラーラベルは、径の異なるスクリューとそれに対応
するプレートのサイズを選択する際の視覚的補助として利用されています。
156
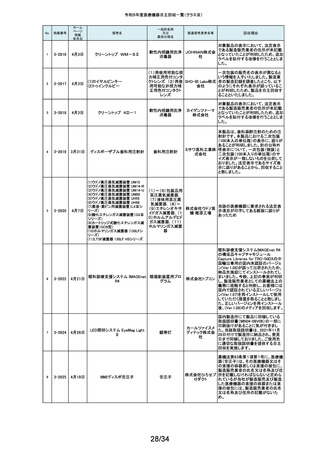
157
158
159
2-11376
2-11377
2-11379
2-11380
RapidSorbシステム
吸収性体内固定用プ
レート
9月14日
大動脈内バルーンポンプ
CARDIOSAVE
海外製造元データスコープ社の調査において、ソフトウェアバージョンC.06が
インストールされた機器において、以下3つの不具合が発生するおそれがある
ことが判明しました。事象1:本製品に使用されているTreck社製TCP/IPソフト
ウェアライブラリのサイバーセキュリティに脆弱性(Ripple20)が認められてお
り、これら脆弱性のいずれかが悪用された場合、イーサネット通信が失われ、
ゲティン 本製品から病院情報システム/臨床情報システム(HIS/CIS)に治療及び波形
ゲグルー データが送信できなくなるおそれ。しかしながら、本製品との通信は消失しま
補助循環用バルーンポ
プ・ジャパ すが、IABP療法の施行、継続及び本製品の性能への影響はありません。事
ンプ駆動装置
ン株式会 象2:バッテリースロット内にバッテリーがひとつだけ挿入され、そのバッテリー
が充電状態である特定の条件下でバッテリーを取り外した際に、本製品の動
社
作が停止する事象が発生するおそれ。事象3:本製品の駆動中、製品内部の
基盤間に通信障害が発生したことにより、本製品の動作が停止する事象が発
生するおそれ。当該不具合への対策として、海外製造元は、ソフトウェアバー
ジョンD.00にアップデートする自主改修に着手しました。これを受けて、本邦に
おいても同様の自主改修措置に着手することを決定しました。
9月15日
メドライン サージカルカスタム
キット外科用
メドライ 液セット」(医療機器)について、製造販売業者であるテルモ株式会社より、一
単回使用クラスⅢ処置 ン・ジャパ 部製品で、チューブとロックコネクターの接合力を保持するための前処理工程
キット
ン合同会 が未実施であった製品が誤って出荷されたとの連絡を受けました。この連絡
を受けて、弊社が製造販売したキット製品においても、同様の不具合が発生
社
弊社が製造販売するキット製品の構成品である「テルフュージョンポンプ用輸
160
2-11382
する可能性を否定できないため、自主回収することを決定しました。
161
2-11385
9月19日
Enterprise ベッド
汎用診療・処置台
世界市場における市販後調査データの継続的なモニタリングを通じて、移動
時の補助機能オプションを使用中のベッドの予期せぬ動作に関する苦情が増
アルジョ・ 加傾向にあることを確認しました。報告された不具合は検査において再現さ
ジャパン れませんでした。調査の結果、事象発生の原因は使用方法を含む複合的な
株式会社 ものであると考えられますが、事象が発生する可能性を低減するための補助
機能オプション部分のソフトウェアのアップグレードもしくは基板交換を行いま
す。
顧客から、表示のラベルの製品とパッケージの中の製品の先端径サイズが
162
2-11387
9月19日
T’Sボーンスプレッディング
株式会社 異なっていたとの情報を頂き、調査を行ったところ 商品コード:301-36343(製
歯科用インプラント手術
インプラ 品の先端径2.0mm)の製品に対し、商品コード:301-36342(製品の先端径
器具
テックス 1.7mm)のラベルが貼られているロットがあることが判明したため該当製品の
自主回収をいたします。
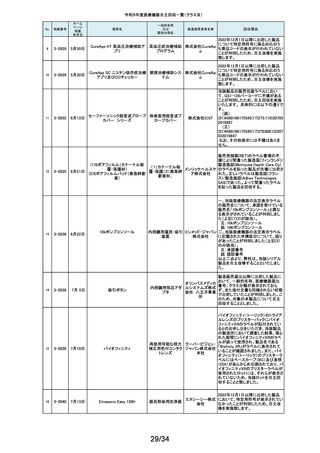
163
2-11388
9月20日
ビーバー ブレード
単回使用メス
ビーバー
ビジテック
インター 国内の医療機関より、形状の異なる製品が混入した事例が報告されました。
ナショナ 国内市場に出荷されている対象ロットについて、同様の不具合の発生の可能
ルジャパ 性を否定できないため、自主回収を実施することとしました。
ン株式会
社
弊社が製造販売しておりますジェルコI.V.カテーテルⅡにおきまして、海外製
164
2-11389
9月19日
ジェルコI.V.カテーテルⅡ
9月20日
PENTAX Medical 内視鏡用コー
ルドスネア VDK-CS
スミスメ 造元から本製品の特定ロットにおいて、製造上の不具合によりカテーテル挿
プラスチックカニューレ ディカル・ 入部位で液漏れが生じる可能性があることが判明したため、当該ロットについ
型滅菌済み穿刺針
ジャパン て自主回収を行う旨の連絡がありました。弊社としましては、この連絡を受
株式会社 け、製品の品質有効性安全性および患者への影響、法令への遵守を考慮
し、対象製品の自主回収を行うことにいたしました。
165
2-11390
自然開口向け単回使
用内視鏡用非能動処
置具
HOYA株 当該製品の一部が患者の体内へ脱落する可能性のあることがわかりました
式会社 ので、自主回収を実施することとしました。
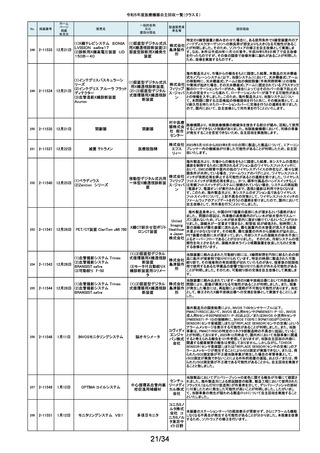
14/34
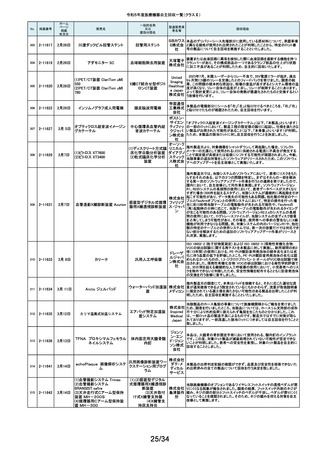
No.
掲載番号
ホーム
ページ
掲載
年月日
販売名
一般的名称
又は
薬効分類名
製造販売業
者名等
回収理由
154
2-11372
9月11日
EnSite X EPシステム
国内外の医療機関より、ソフトウェアバージョン3.0がインストールされたEnsite
X EPシステムとTactiFlex SEイリゲーションカテーテルを使用した際、ベクトル
アロー及びディフレクションインジケーターの向きが90度ずれて表示されると
アボットメ の報告を受領しました。調査の結果、バージョン3.0のソフトウェアと一部の
心臓カテーテル用検査 ディカル TactiFlex SEイリゲーションカテーテルに使用している構成部品との間に、互
換性の問題があることがわかりました。バージョン2.0.1以下のソフトウェアをイ
装置
ジャパン ンストールしたEnsite X EPシステム及びTactiFlex SEイリゲーションカテーテ
合同会社 ル以外のカテーテルに当該問題は生じません。この問題を解決するため、
バージョン3.0のソフトウェアがインストールされたEnsite X EPシステムを、修
正されたソフトウェア(バージョン3.0.1)にアップグレードするための自主改修を
行います。
155
2-11374
9月12日
レトロ用ドリルシステム
Arthrex
単回使用手術用ドリル
製造販売認証書に記載されていない登録製造所において製造されていた製
Japan合 品が出荷されていたことが確認されたため。
アタッチメント
同会社
9月13日
テルフュージョンポンプ用輸液
セット
医療機関から、テルフュージョンポンプ用輸液セットについて、使用中に
チューブとロックコネクターとの接合部から液漏れ、またはチューブからロック
輸液ポンプ用輸液セッ テルモ株 コネクターが外れたとの品質情報を受け付けました。詳細に調査した結果、
チューブとロックコネクターの接合力を保持するための前処理工程が未実施
ト
式会社 であった製品が誤って出荷されていることが判明しました。出荷済み製品に同
様の状態の製品が一部含まれている可能性があることから、自主回収を実施
することとしました。
9月13日
ボストン・ S-ICDパルスジェネレータ(承認番号:22700BZX00132000)(以下、S-ICD)と
サイエン ラティチュード Wave コミュニケータ(認証番号: 226ADBZX00186000)(以下、
(1)S-ICDプログラマ
植込み能動型機器用プ ティフィッ 遠隔モニタリングシステム)の通信時においてごく稀にセンシングが無効にな
(2)ラティチュード プログラミング
ログラマ
クジャパ る事象が発生することが判明しました。この事象は24時間後に自動的に復旧
システム 3300
ン株式会 しますが、本改修により、この事象が発生した場合でも1心周期後にセンシン
グが再開するようになります。
社
9月14日
本品は、頭蓋顎顔面領域における、骨奇形や骨折治療時に骨折間隙を埋
め、骨折部位を応力から保護するため、骨折片に取付けるプレート製品で
す。この度、当該製品の外箱に貼付されている製造元ラベルにあるカラーラ
ジョンソ ベル※1が、本来であれば厚さ0.8mmを示す「赤色」でなければならないとこ
ン・エン ろ、厚さ1.2mmを示す「青色」のカラーラベルが貼付されている製品が確認さ
ド・ジョン れました。国内在庫を確認したところ、対象ロット製品において、同様事象が
ソン株式 発生していることが判明しました。また、ラベルに記載のスクリュー長と中身の
会社 製品のスクリュー長は同じであり、カラーラベルの情報だけが間違っているこ
とが分かっています。患者様への安全性を重視し、対象製品を自主的に回収
することとしました。※1:カラーラベルは、径の異なるスクリューとそれに対応
するプレートのサイズを選択する際の視覚的補助として利用されています。
156
157
158
159
2-11376
2-11377
2-11379
2-11380
RapidSorbシステム
吸収性体内固定用プ
レート
9月14日
大動脈内バルーンポンプ
CARDIOSAVE
海外製造元データスコープ社の調査において、ソフトウェアバージョンC.06が
インストールされた機器において、以下3つの不具合が発生するおそれがある
ことが判明しました。事象1:本製品に使用されているTreck社製TCP/IPソフト
ウェアライブラリのサイバーセキュリティに脆弱性(Ripple20)が認められてお
り、これら脆弱性のいずれかが悪用された場合、イーサネット通信が失われ、
ゲティン 本製品から病院情報システム/臨床情報システム(HIS/CIS)に治療及び波形
ゲグルー データが送信できなくなるおそれ。しかしながら、本製品との通信は消失しま
補助循環用バルーンポ
プ・ジャパ すが、IABP療法の施行、継続及び本製品の性能への影響はありません。事
ンプ駆動装置
ン株式会 象2:バッテリースロット内にバッテリーがひとつだけ挿入され、そのバッテリー
が充電状態である特定の条件下でバッテリーを取り外した際に、本製品の動
社
作が停止する事象が発生するおそれ。事象3:本製品の駆動中、製品内部の
基盤間に通信障害が発生したことにより、本製品の動作が停止する事象が発
生するおそれ。当該不具合への対策として、海外製造元は、ソフトウェアバー
ジョンD.00にアップデートする自主改修に着手しました。これを受けて、本邦に
おいても同様の自主改修措置に着手することを決定しました。
9月15日
メドライン サージカルカスタム
キット外科用
メドライ 液セット」(医療機器)について、製造販売業者であるテルモ株式会社より、一
単回使用クラスⅢ処置 ン・ジャパ 部製品で、チューブとロックコネクターの接合力を保持するための前処理工程
キット
ン合同会 が未実施であった製品が誤って出荷されたとの連絡を受けました。この連絡
を受けて、弊社が製造販売したキット製品においても、同様の不具合が発生
社
弊社が製造販売するキット製品の構成品である「テルフュージョンポンプ用輸
160
2-11382
する可能性を否定できないため、自主回収することを決定しました。
161
2-11385
9月19日
Enterprise ベッド
汎用診療・処置台
世界市場における市販後調査データの継続的なモニタリングを通じて、移動
時の補助機能オプションを使用中のベッドの予期せぬ動作に関する苦情が増
アルジョ・ 加傾向にあることを確認しました。報告された不具合は検査において再現さ
ジャパン れませんでした。調査の結果、事象発生の原因は使用方法を含む複合的な
株式会社 ものであると考えられますが、事象が発生する可能性を低減するための補助
機能オプション部分のソフトウェアのアップグレードもしくは基板交換を行いま
す。
顧客から、表示のラベルの製品とパッケージの中の製品の先端径サイズが
162
2-11387
9月19日
T’Sボーンスプレッディング
株式会社 異なっていたとの情報を頂き、調査を行ったところ 商品コード:301-36343(製
歯科用インプラント手術
インプラ 品の先端径2.0mm)の製品に対し、商品コード:301-36342(製品の先端径
器具
テックス 1.7mm)のラベルが貼られているロットがあることが判明したため該当製品の
自主回収をいたします。
163
2-11388
9月20日
ビーバー ブレード
単回使用メス
ビーバー
ビジテック
インター 国内の医療機関より、形状の異なる製品が混入した事例が報告されました。
ナショナ 国内市場に出荷されている対象ロットについて、同様の不具合の発生の可能
ルジャパ 性を否定できないため、自主回収を実施することとしました。
ン株式会
社
弊社が製造販売しておりますジェルコI.V.カテーテルⅡにおきまして、海外製
164
2-11389
9月19日
ジェルコI.V.カテーテルⅡ
9月20日
PENTAX Medical 内視鏡用コー
ルドスネア VDK-CS
スミスメ 造元から本製品の特定ロットにおいて、製造上の不具合によりカテーテル挿
プラスチックカニューレ ディカル・ 入部位で液漏れが生じる可能性があることが判明したため、当該ロットについ
型滅菌済み穿刺針
ジャパン て自主回収を行う旨の連絡がありました。弊社としましては、この連絡を受
株式会社 け、製品の品質有効性安全性および患者への影響、法令への遵守を考慮
し、対象製品の自主回収を行うことにいたしました。
165
2-11390
自然開口向け単回使
用内視鏡用非能動処
置具
HOYA株 当該製品の一部が患者の体内へ脱落する可能性のあることがわかりました
式会社 ので、自主回収を実施することとしました。
14/34