よむ、つかう、まなぶ。
資料4-2 令和5年度医療機器・再生医療等製品の自主回収一覧[2.0MB] (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41653.html |
| 出典情報 | 薬事審議会 医療機器・再生医療等製品安全対策部会(令和6年度第1回 8/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
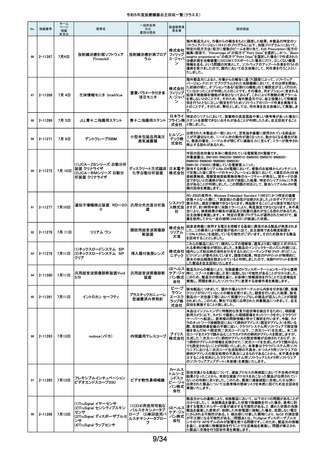
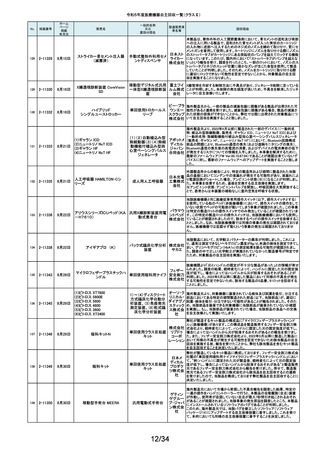
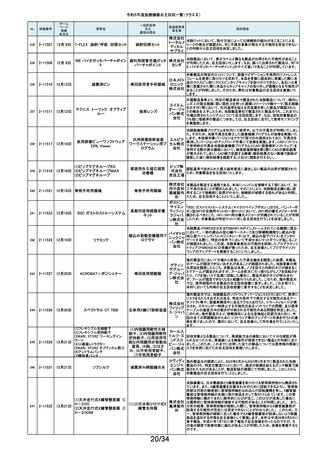
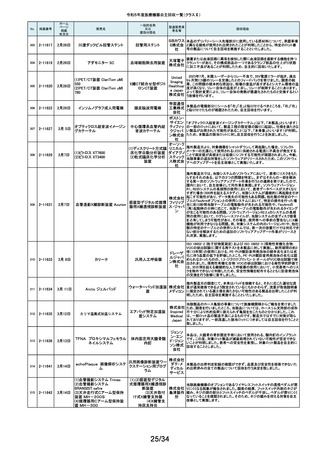
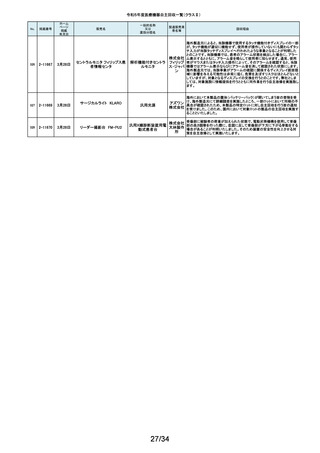
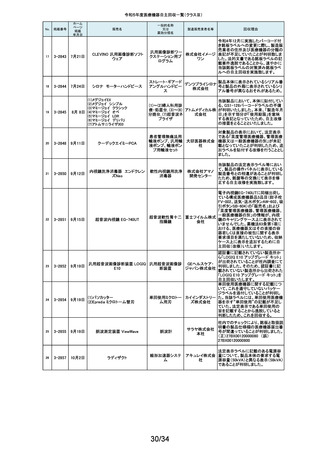
令和5年度医療機器自主回収一覧(クラスⅡ)
No.
掲載番号
ホーム
ページ
掲載
年月日
販売名
一般的名称
又は
薬効分類名
259
2-11553
1月15日
MMI 低圧持続吸引器
創部用ドレナージキット
村中医療
器株式会 医療機関より、当該医療機器のトロッカー針とドレインチューブの接続が緩く、
容易に抜けると指摘がありました。当該医療機器において、同様の事象が発
社 総合 生することを否定できないため、特定ロットの自主回収を実施致します。
センター
260
2-11556
1月22日
サーモガード HQ コンソール
中心静脈留置型経皮
的体温調節装置コント
ロールユニット
旭化成 国内における点検時の報告より、使用開始前のプライミングにおけるオートス
ゾールメ トップ機能(2分後の自動停止)が特定のシリアル番号のコンソールにおいて、
作動しない可能性が判明いたしました。調査の結果、タイマースイッチに関わ
ディカル る基板に起因して当該事象が発生するおそれがあることが判明いたしまし
株式会社 た。対象品に対して、自主改修として原因基板の交換を実施いたします。
261
2-11557
1月19日
ガッタパーチャポイント
製造販売業
者名等
回収理由
株式会社 指定管理医療機器製造販売認証書の記載と異なる色素原料の使用及び、異
歯科用根管充填ガッタ
東洋化学 なる配合量のワックスで製品の製造を行なっていたことが判明しました。この
パーチャポイント
研究所 ため当該ロットを回収することとします。
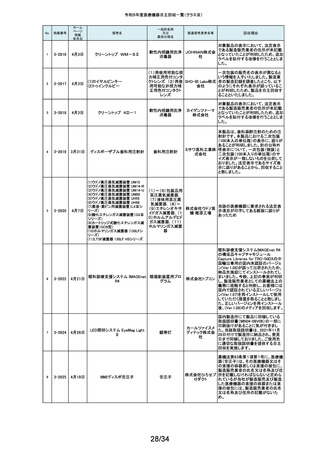
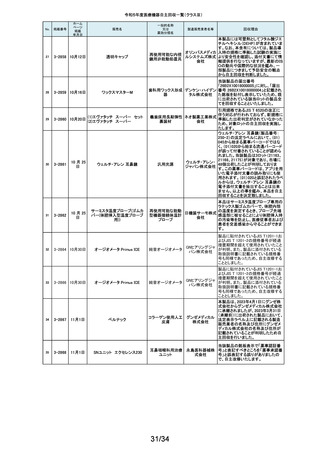
当該製品の外国製造業者であるDutch Ophthalmic Research Center
International b.v.より、レーザーファイバー先端部(チップ)の手動操作(突出お
262
2-11558
1月22日
アール よび格納)が行えない製品が出荷されたため、回収を実施する旨の連絡を受
DORC ディスポーザブル眼内 眼科用レーザ光凝固装 イーメディ けました。同社による調査の結果、レーザーファイバーと操作部(スライダー)
レーザープローブ
置滅菌済みプローブ カル株式 を固定しているネジとネジ穴の形状に不適合があり、ネジ止めした際にスライ
会社 ダーにクラック(ひび割れ)が生じ、固定が十分できていないことが原因である
とわかりました。日本国内においてチップの突出および格納が行えなかった
旨の報告は受けておりませんが、当該製品を自主回収することに致しました。
263
2-11559
1月23日
アパセラム-L3
人工骨インプラント
医療機関より、人工骨(販売名:アパセラム-L4)を用いた治療の際に、法定表
示で示される製品とは異なる製品が封入されているとの報告を受けました。
HOYA 返却された製品を調査した結果、医療機関で発見された製品と同日生産して
Technosu いた製品(販売名;アパセラム-L3)との包装入れ違いにより、法定表示製品と
rgical株式 異なる製品が封入されたことが判明しました。医療機関にて発見された製品
会社 は調査のため、既に製造販売業者が確保していることから、製品包装の入れ
違えとなった製品(販売名:アパセラム-L3)の自主回収を実施することと致し
ました。
264
2-11560
1月24日
ダーマキャリアⅡ
自家植皮拡張器
ジンマー・
バイオメッ 拡大率3倍と表示された製品に拡大率1.5倍のダーマキャリアⅡが包装されて
ト合同会 いる可能性があるため、回収を実施します。
社
265
2-11563
1月24日
Mendec Spine 注入システム
ジェイソ 施設で本品を用いたBKP手技前に注入デバイスのピストン・ノブを押し引きす
手動式整形外科用セメ ル・メディ る際、かなりの力を要する製品が確認されました。輸送・保管状態において、
ントディスペンサ
カル株式 注意事項等情報に記載されている保管方法からの逸脱があったことを否定で
会社 きないため、当該ロットの自主回収を実施致します。
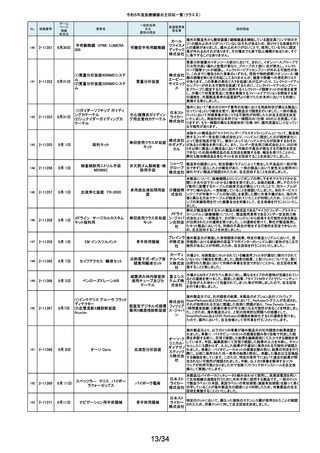
266
2-11564
1月26日
(1)据置型アナログ式
当該装置の天板において、減弱当量がJISで規定された値(1.2mmAL当量)を
(1)診断用Ⅹ線装置 X'sy Pro 汎用X線診断装置(2)汎
株式会社 0.1~0.3mmAL当量上回っているものがあることが判明しました。これに該当
(2)Ⅹ線撮影テーブル BK-1T 用X線診断装置用非電
する可能性がある装置について、JISの規定を満たす天板へ の交換を自主
島津製作 改修として実施いたします。本件は平成28年3月31日に着手報告、平成29年
(3)Ⅹ線撮影テーブル BK-1T 動式患者台(3)汎用X線
所
11月20日に終了報告で自主改修を行ったものですが、その後の調査で改修
M
診断装置用非電動式
対象に漏れがあることが判明したため、改修を実施するものです。
患者台
267
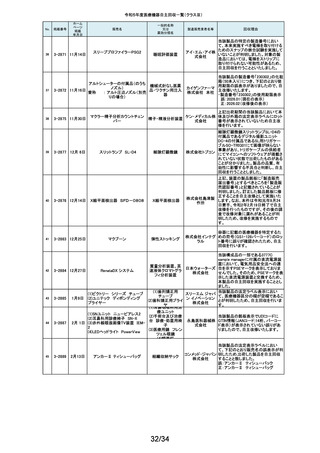
2-11565
1月26日
乳房用X線診断装置
Senographe Pristina
268
2-11566
1月26日
心電計(解析機能付)MAC
VU360
GEヘル 製造元からの連絡により、IEC 60601-2-45で規定されるX線照射中の可聴音
据置型デジタル式乳房 スケア・ を発さない可能性のあることが確認されました。このため、製造元の情報を基
用X線診断装置
ジャパン に、お客様に情報提供を行うとともに、問題を修正したソフトウェアに変更する
株式会社 改修作業を実施します。
汎用心電計
GEヘルス 製造元からの連絡により、製造元での社内検証中にIEC 60601-2-25校正用
ケア・ジャ 心電図の試験の試験基準を満たしていないことが確認されました。このため、
パン株式 製造元の情報を基に、お客様に情報提供を行うとともに、問題を修正したソフ
会社 トウェアに変更する改修作業を実施します。
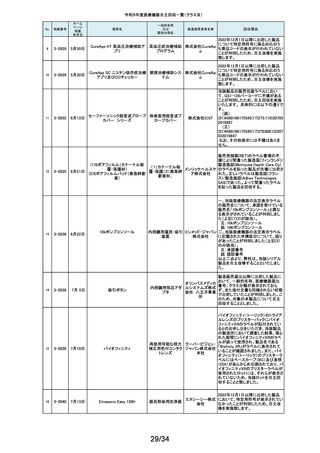
単回使用遠心ポンプ
ゲティン 不良(包装材料内部から外部に通じる間隙)が存在するおそれがあることが
ゲグルー 分かりました。これにより、個別包装材料に不具合があった場合、本製品の開
プ・ジャパ 封後は滅菌性が徐々に失われていくおそれがあります。調査の結果、封止不
ン株式会 良が存在するのは、当該滅菌バッグの3製造ロットであることが判明したた
め、このロットの滅菌バッグを使用した製品について、海外製造元は自主回
社
本製品の個別包装材料の各辺は圧着により完全に封止されておりますが、
社内検証試験において、特定の包装材料のロットにおいて、ごく微小な封止
269
2-11569
1月29日
ROTAFLOW 遠心ポンプ
収措置に着手しました。これを受けて、本邦においても同様の自主回収措置
に着手することを決定しました。
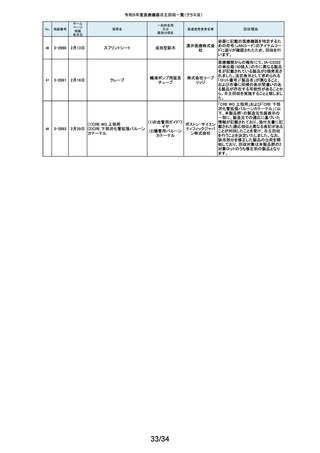
270
2-11571
2月1日
アンギオグラフィックカテーテル
ガデリウ 国内の医療機関より、同じ部品を使用している他のカテーテルのルアーコネ
中心循環系血管造影 ス・メディ クターにガイドワイヤーを通しにくい事例が報告されました。製造元の調査か
ら、成形工程の問題により、ルアーコネクターが規格と異なる製品が含まれて
用カテーテル
カル株式 いる可能性が判明しました。当該ロットについて、同様の不具合の発生の可
会社 能性を否定出来ない事から、自主回収を決定することとしました。
271
2-11572
2月1日
ウェッジプレッシャーカテーテル
肺動脈用カテーテル
ガデリウ 国内の医療機関より、カテーテルのルアーコネクターにガイドワイヤーを通し
ス・メディ にくい事例が報告されました。製造元の調査から、成形工程の問題により、ル
アーコネクターが規格と異なる製品が含まれている可能性が判明しました。当
カル株式 該ロットについて、同様の不具合の発生の可能性を否定出来ない事から、自
会社 主回収を決定することとしました。
272
2-11573
2月 1日
ExcelsiusGPSガイド機能付きナ
ビゲーション システム器械セッ
ト
脊椎手術用器械
グローバ 製品の一部の内側に隙間が存在し、蒸気滅菌前の洗浄がより困難になるた
スメディカ め、製品の内側が十分に滅菌されない可能性があります。このため、再滅菌
による無菌性が担保できない製品と判断し、これまでに出荷した全ての製品
ル株式会 について、患者様の感染リスクを未然に防ぐために自主回収を実施いたしま
社
す。
免疫発光測定装置
ベックマ 対策として、2023年5月よりソフトウェアバージョンアップを改修として実施して
ン・コール おりました。しかしながら、当該改修を実施した後においても、オンボード希釈
ター株式 機能を使用している場合、アクセス hsTnI試薬パックにアッセイ内キャリー
会社 オーバーの恐れがあることが判明しました。この度、対象シリアル番号の装置
弊社製造元からの情報により、心筋トロポニンI(cTnI)濃度が高い検体の測定
後にキャリーオーバーが発生する可能性があることが確認されました。当該
273
2-11574
2月 1日
ユニセルDxI800システム
について、当該事象の追加対策をしたソフトウエアへのバージョンアップを改
修として実施いたします。
22/34
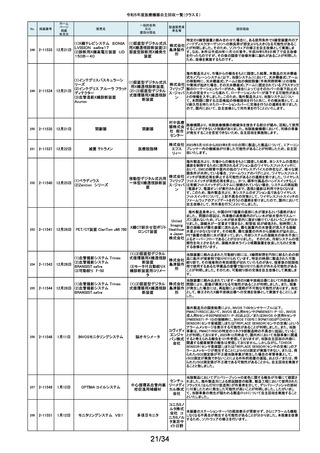
No.
掲載番号
ホーム
ページ
掲載
年月日
販売名
一般的名称
又は
薬効分類名
259
2-11553
1月15日
MMI 低圧持続吸引器
創部用ドレナージキット
村中医療
器株式会 医療機関より、当該医療機器のトロッカー針とドレインチューブの接続が緩く、
容易に抜けると指摘がありました。当該医療機器において、同様の事象が発
社 総合 生することを否定できないため、特定ロットの自主回収を実施致します。
センター
260
2-11556
1月22日
サーモガード HQ コンソール
中心静脈留置型経皮
的体温調節装置コント
ロールユニット
旭化成 国内における点検時の報告より、使用開始前のプライミングにおけるオートス
ゾールメ トップ機能(2分後の自動停止)が特定のシリアル番号のコンソールにおいて、
作動しない可能性が判明いたしました。調査の結果、タイマースイッチに関わ
ディカル る基板に起因して当該事象が発生するおそれがあることが判明いたしまし
株式会社 た。対象品に対して、自主改修として原因基板の交換を実施いたします。
261
2-11557
1月19日
ガッタパーチャポイント
製造販売業
者名等
回収理由
株式会社 指定管理医療機器製造販売認証書の記載と異なる色素原料の使用及び、異
歯科用根管充填ガッタ
東洋化学 なる配合量のワックスで製品の製造を行なっていたことが判明しました。この
パーチャポイント
研究所 ため当該ロットを回収することとします。
当該製品の外国製造業者であるDutch Ophthalmic Research Center
International b.v.より、レーザーファイバー先端部(チップ)の手動操作(突出お
262
2-11558
1月22日
アール よび格納)が行えない製品が出荷されたため、回収を実施する旨の連絡を受
DORC ディスポーザブル眼内 眼科用レーザ光凝固装 イーメディ けました。同社による調査の結果、レーザーファイバーと操作部(スライダー)
レーザープローブ
置滅菌済みプローブ カル株式 を固定しているネジとネジ穴の形状に不適合があり、ネジ止めした際にスライ
会社 ダーにクラック(ひび割れ)が生じ、固定が十分できていないことが原因である
とわかりました。日本国内においてチップの突出および格納が行えなかった
旨の報告は受けておりませんが、当該製品を自主回収することに致しました。
263
2-11559
1月23日
アパセラム-L3
人工骨インプラント
医療機関より、人工骨(販売名:アパセラム-L4)を用いた治療の際に、法定表
示で示される製品とは異なる製品が封入されているとの報告を受けました。
HOYA 返却された製品を調査した結果、医療機関で発見された製品と同日生産して
Technosu いた製品(販売名;アパセラム-L3)との包装入れ違いにより、法定表示製品と
rgical株式 異なる製品が封入されたことが判明しました。医療機関にて発見された製品
会社 は調査のため、既に製造販売業者が確保していることから、製品包装の入れ
違えとなった製品(販売名:アパセラム-L3)の自主回収を実施することと致し
ました。
264
2-11560
1月24日
ダーマキャリアⅡ
自家植皮拡張器
ジンマー・
バイオメッ 拡大率3倍と表示された製品に拡大率1.5倍のダーマキャリアⅡが包装されて
ト合同会 いる可能性があるため、回収を実施します。
社
265
2-11563
1月24日
Mendec Spine 注入システム
ジェイソ 施設で本品を用いたBKP手技前に注入デバイスのピストン・ノブを押し引きす
手動式整形外科用セメ ル・メディ る際、かなりの力を要する製品が確認されました。輸送・保管状態において、
ントディスペンサ
カル株式 注意事項等情報に記載されている保管方法からの逸脱があったことを否定で
会社 きないため、当該ロットの自主回収を実施致します。
266
2-11564
1月26日
(1)据置型アナログ式
当該装置の天板において、減弱当量がJISで規定された値(1.2mmAL当量)を
(1)診断用Ⅹ線装置 X'sy Pro 汎用X線診断装置(2)汎
株式会社 0.1~0.3mmAL当量上回っているものがあることが判明しました。これに該当
(2)Ⅹ線撮影テーブル BK-1T 用X線診断装置用非電
する可能性がある装置について、JISの規定を満たす天板へ の交換を自主
島津製作 改修として実施いたします。本件は平成28年3月31日に着手報告、平成29年
(3)Ⅹ線撮影テーブル BK-1T 動式患者台(3)汎用X線
所
11月20日に終了報告で自主改修を行ったものですが、その後の調査で改修
M
診断装置用非電動式
対象に漏れがあることが判明したため、改修を実施するものです。
患者台
267
2-11565
1月26日
乳房用X線診断装置
Senographe Pristina
268
2-11566
1月26日
心電計(解析機能付)MAC
VU360
GEヘル 製造元からの連絡により、IEC 60601-2-45で規定されるX線照射中の可聴音
据置型デジタル式乳房 スケア・ を発さない可能性のあることが確認されました。このため、製造元の情報を基
用X線診断装置
ジャパン に、お客様に情報提供を行うとともに、問題を修正したソフトウェアに変更する
株式会社 改修作業を実施します。
汎用心電計
GEヘルス 製造元からの連絡により、製造元での社内検証中にIEC 60601-2-25校正用
ケア・ジャ 心電図の試験の試験基準を満たしていないことが確認されました。このため、
パン株式 製造元の情報を基に、お客様に情報提供を行うとともに、問題を修正したソフ
会社 トウェアに変更する改修作業を実施します。
単回使用遠心ポンプ
ゲティン 不良(包装材料内部から外部に通じる間隙)が存在するおそれがあることが
ゲグルー 分かりました。これにより、個別包装材料に不具合があった場合、本製品の開
プ・ジャパ 封後は滅菌性が徐々に失われていくおそれがあります。調査の結果、封止不
ン株式会 良が存在するのは、当該滅菌バッグの3製造ロットであることが判明したた
め、このロットの滅菌バッグを使用した製品について、海外製造元は自主回
社
本製品の個別包装材料の各辺は圧着により完全に封止されておりますが、
社内検証試験において、特定の包装材料のロットにおいて、ごく微小な封止
269
2-11569
1月29日
ROTAFLOW 遠心ポンプ
収措置に着手しました。これを受けて、本邦においても同様の自主回収措置
に着手することを決定しました。
270
2-11571
2月1日
アンギオグラフィックカテーテル
ガデリウ 国内の医療機関より、同じ部品を使用している他のカテーテルのルアーコネ
中心循環系血管造影 ス・メディ クターにガイドワイヤーを通しにくい事例が報告されました。製造元の調査か
ら、成形工程の問題により、ルアーコネクターが規格と異なる製品が含まれて
用カテーテル
カル株式 いる可能性が判明しました。当該ロットについて、同様の不具合の発生の可
会社 能性を否定出来ない事から、自主回収を決定することとしました。
271
2-11572
2月1日
ウェッジプレッシャーカテーテル
肺動脈用カテーテル
ガデリウ 国内の医療機関より、カテーテルのルアーコネクターにガイドワイヤーを通し
ス・メディ にくい事例が報告されました。製造元の調査から、成形工程の問題により、ル
アーコネクターが規格と異なる製品が含まれている可能性が判明しました。当
カル株式 該ロットについて、同様の不具合の発生の可能性を否定出来ない事から、自
会社 主回収を決定することとしました。
272
2-11573
2月 1日
ExcelsiusGPSガイド機能付きナ
ビゲーション システム器械セッ
ト
脊椎手術用器械
グローバ 製品の一部の内側に隙間が存在し、蒸気滅菌前の洗浄がより困難になるた
スメディカ め、製品の内側が十分に滅菌されない可能性があります。このため、再滅菌
による無菌性が担保できない製品と判断し、これまでに出荷した全ての製品
ル株式会 について、患者様の感染リスクを未然に防ぐために自主回収を実施いたしま
社
す。
免疫発光測定装置
ベックマ 対策として、2023年5月よりソフトウェアバージョンアップを改修として実施して
ン・コール おりました。しかしながら、当該改修を実施した後においても、オンボード希釈
ター株式 機能を使用している場合、アクセス hsTnI試薬パックにアッセイ内キャリー
会社 オーバーの恐れがあることが判明しました。この度、対象シリアル番号の装置
弊社製造元からの情報により、心筋トロポニンI(cTnI)濃度が高い検体の測定
後にキャリーオーバーが発生する可能性があることが確認されました。当該
273
2-11574
2月 1日
ユニセルDxI800システム
について、当該事象の追加対策をしたソフトウエアへのバージョンアップを改
修として実施いたします。
22/34