よむ、つかう、まなぶ。
資料1-2 早期導入を要望する医療機器等に関する要望書【No.2024-1】 (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42226.html |
| 出典情報 | 医療ニーズの高い医療機器等の早期導入に関する検討会(第38回 8/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
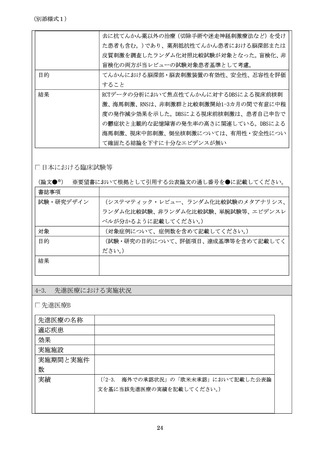
(別添様式1)
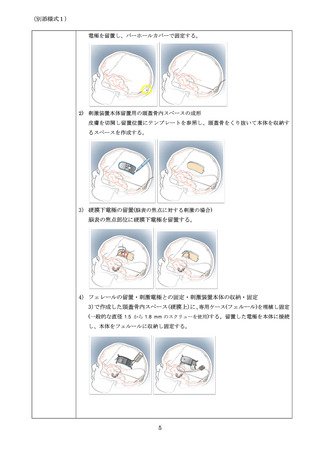
減することにある。
欧州
CE マーク年月日
承認されている適
応の内容
(対象疾患、対象部位、使用目的等について記載してください。
)
欧米未承認
①
優れた試験成績が論文等で公表されているもの
②
医師主導治験を実施中または終了したもの
③
先進医療Bで一定の実績があるもの
(上記に該当すると考えた根拠を記載してください。①又は③に該当する場合は、根拠となる公
表論文等を必ず記載してください。
)
(論文●※)
※要望書において根拠として引用する公表論文の通し番号を●に記載してください。
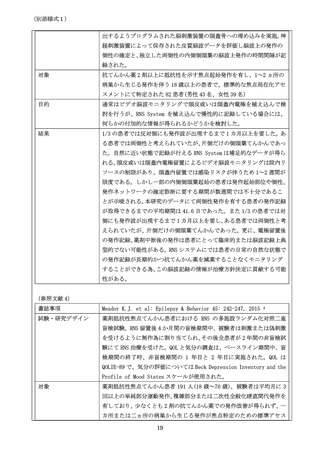
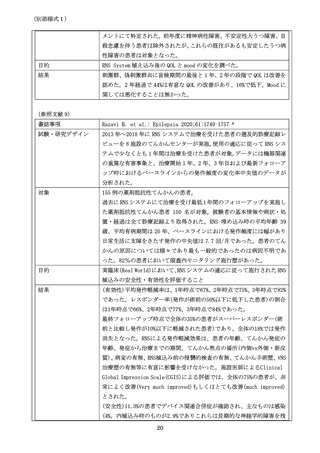
書誌事項
試験・研究デザイン
(システマティック・レビュー、ランダム化比較試験のメタアナリシス、ラ
ンダム化比較試験、非ランダム化比較試験、単腕試験等、エビデンスレベル
が分かるように記載してください。
)
対象
(対象症例について、症例数を含めて記載してください。
)
目的
(試験・研究の目的について、評価項目、達成基準等を含めて記載してくだ
さい。)
結果
2-4. 国内の承認内容
(適応外医療機器等のみ記載してください。)
承認年月日
承認番号
製造販売業者
承認されている適
応の内容
(要望品目の添付文書等に記載されている「使用目的又は効果」の内容
を転記してください。
)
11
減することにある。
欧州
CE マーク年月日
承認されている適
応の内容
(対象疾患、対象部位、使用目的等について記載してください。
)
欧米未承認
①
優れた試験成績が論文等で公表されているもの
②
医師主導治験を実施中または終了したもの
③
先進医療Bで一定の実績があるもの
(上記に該当すると考えた根拠を記載してください。①又は③に該当する場合は、根拠となる公
表論文等を必ず記載してください。
)
(論文●※)
※要望書において根拠として引用する公表論文の通し番号を●に記載してください。
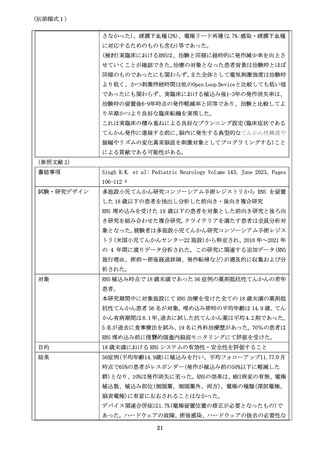
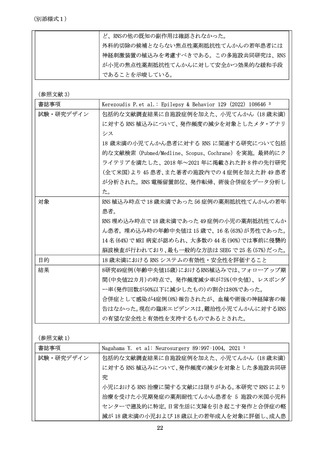
書誌事項
試験・研究デザイン
(システマティック・レビュー、ランダム化比較試験のメタアナリシス、ラ
ンダム化比較試験、非ランダム化比較試験、単腕試験等、エビデンスレベル
が分かるように記載してください。
)
対象
(対象症例について、症例数を含めて記載してください。
)
目的
(試験・研究の目的について、評価項目、達成基準等を含めて記載してくだ
さい。)
結果
2-4. 国内の承認内容
(適応外医療機器等のみ記載してください。)
承認年月日
承認番号
製造販売業者
承認されている適
応の内容
(要望品目の添付文書等に記載されている「使用目的又は効果」の内容
を転記してください。
)
11