よむ、つかう、まなぶ。
資料1-2 早期導入を要望する医療機器等に関する要望書【No.2024-1】 (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42226.html |
| 出典情報 | 医療ニーズの高い医療機器等の早期導入に関する検討会(第38回 8/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(別添様式1)
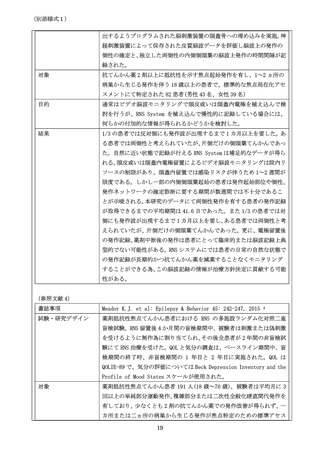
フォローアップ)では、同一患者群ではない研究内容を比較することには課題があるものの、発作減少
率において臨床試験結果と差があり、患者選択(患者 IQ、焦点部位)や施設における DBS 手術の経験が
臨床成績に影響しうる可能性が指摘されている 13。機能面においても、バッテリー寿命が 4-5 年であり
刺激装置植込みの為の再手術回数が多くなること、発作毎の脳波記録が行われず脳波の活用が限定的で
あることなどに課題がある。
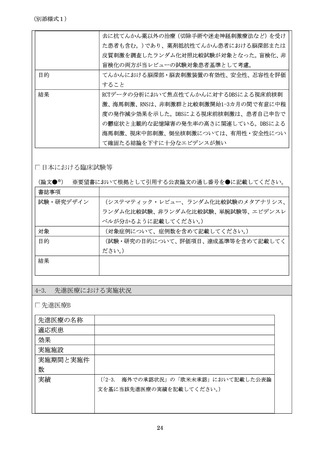
4.要望品目の臨床試験成績等に関する情報
4-1.
治験実施状況
治験の実施
・
RNS System, Summary of Safety and Effectiveness, P100026. U S Department of Health and
Human Services, Food and Drug Administration.
Available at: https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpma/pma.cfm?id=P100026
Accessed 2023, Jan 29th. (参照文献16・36・12・28)
治験機器
RNS System (NeuroPace, Mountain View, CA, USA)
要望品目と同一
治験実施国
米国
治験実施期間
以下の 3 期間に分かれるが承認申請に重要な結果は 2)の Pivotal Study
から得られている。
1) Feasibility Study: 2004 年 1 月〜2007 年 12 月 16
2) Pivotal Study: 2005 年 12 月〜2009 年 10 月 36
3) Long-term Treatment Study : 2007 年 4 月~12 28
治験デザイン
多施設二重盲検無作為化比較試験
治験プロトコルの
概要
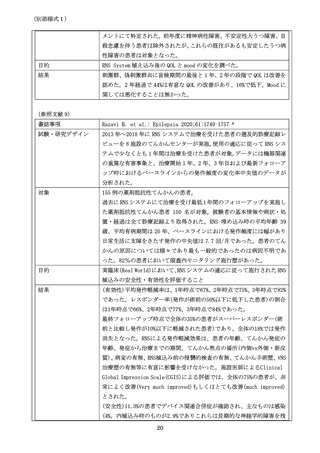
対象は 18 歳以上で部分発作を有する患者で以下 3 項目も満たす症例。
過去に 2 剤以上の抗てんかん発作薬で発作抑制が困難。月に平均 3 回以
上の生活に支障を来すレベルの発作を有する。標準的な検査を終えてお
りてんかん原性(焦点)のある箇所が 1 或いは 2 箇所。
最初に Feasibility Study として予備的に安全性と有効性を確認する試
験が実施された。全体で 65 症例であるが、非盲検 42 例・盲検 23 例と非
盲検が多かった。16 週で全例が非盲検に移行。この試験の結果や知見が
Pivotal Study に反映された。
Pivotal Study は米国内 32 施設において 240 症例が登録された。結果
的に 31 施設で 191 名の患者に RNS System が植込まれ、その有効性と
安全性が検討された。191 例の手術を受けた患者は、最初の 4 週間は大
脳皮質脳波の記録だけを実施した。その後以下の 2 群に無作為に分けら
れた。刺激群は刺激開始後 4 週間は刺激条件の最適化の期間に当てられ、
その後も刺激を継続した。偽刺激群はデバイスを植込まれたのみで刺激
は行われず、盲検期間の 12 週間を過ごした。植え込み術後 20 週を過ぎ
てから、非盲検となり全例で刺激を開始。84 週間を超えて観察を行った。
14
フォローアップ)では、同一患者群ではない研究内容を比較することには課題があるものの、発作減少
率において臨床試験結果と差があり、患者選択(患者 IQ、焦点部位)や施設における DBS 手術の経験が
臨床成績に影響しうる可能性が指摘されている 13。機能面においても、バッテリー寿命が 4-5 年であり
刺激装置植込みの為の再手術回数が多くなること、発作毎の脳波記録が行われず脳波の活用が限定的で
あることなどに課題がある。
4.要望品目の臨床試験成績等に関する情報
4-1.
治験実施状況
治験の実施
・
RNS System, Summary of Safety and Effectiveness, P100026. U S Department of Health and
Human Services, Food and Drug Administration.
Available at: https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpma/pma.cfm?id=P100026
Accessed 2023, Jan 29th. (参照文献16・36・12・28)
治験機器
RNS System (NeuroPace, Mountain View, CA, USA)
要望品目と同一
治験実施国
米国
治験実施期間
以下の 3 期間に分かれるが承認申請に重要な結果は 2)の Pivotal Study
から得られている。
1) Feasibility Study: 2004 年 1 月〜2007 年 12 月 16
2) Pivotal Study: 2005 年 12 月〜2009 年 10 月 36
3) Long-term Treatment Study : 2007 年 4 月~12 28
治験デザイン
多施設二重盲検無作為化比較試験
治験プロトコルの
概要
対象は 18 歳以上で部分発作を有する患者で以下 3 項目も満たす症例。
過去に 2 剤以上の抗てんかん発作薬で発作抑制が困難。月に平均 3 回以
上の生活に支障を来すレベルの発作を有する。標準的な検査を終えてお
りてんかん原性(焦点)のある箇所が 1 或いは 2 箇所。
最初に Feasibility Study として予備的に安全性と有効性を確認する試
験が実施された。全体で 65 症例であるが、非盲検 42 例・盲検 23 例と非
盲検が多かった。16 週で全例が非盲検に移行。この試験の結果や知見が
Pivotal Study に反映された。
Pivotal Study は米国内 32 施設において 240 症例が登録された。結果
的に 31 施設で 191 名の患者に RNS System が植込まれ、その有効性と
安全性が検討された。191 例の手術を受けた患者は、最初の 4 週間は大
脳皮質脳波の記録だけを実施した。その後以下の 2 群に無作為に分けら
れた。刺激群は刺激開始後 4 週間は刺激条件の最適化の期間に当てられ、
その後も刺激を継続した。偽刺激群はデバイスを植込まれたのみで刺激
は行われず、盲検期間の 12 週間を過ごした。植え込み術後 20 週を過ぎ
てから、非盲検となり全例で刺激を開始。84 週間を超えて観察を行った。
14