よむ、つかう、まなぶ。
【参考資料5】抗微生物薬適正使用の手引き 第三版 別冊 (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_45318.html |
| 出典情報 | 厚生科学審議会 感染症部会 薬剤耐性(AMR)に関する小委員会 抗微生物薬適正使用(AMS)等に関する作業部会(第6回 11/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
抗微生物薬適正使用の手引き
(iii)
第三版
別冊
AmpC 産生腸内細菌目細菌
疫学の概要と臨床的特徴
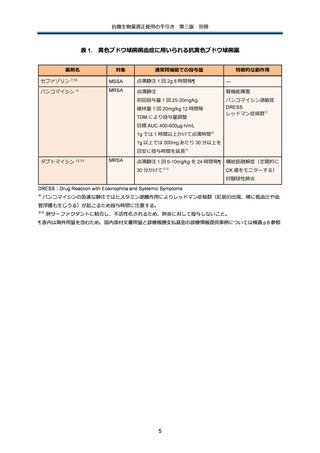
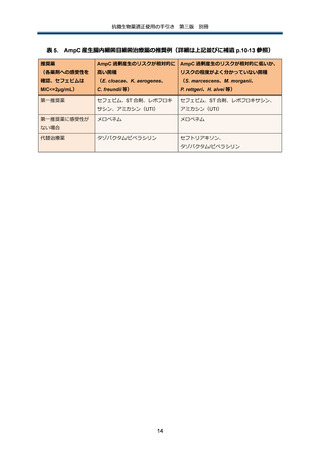
AmpC 遺伝子を染色体にコードする代表的な腸内細菌目細菌としては、Enterobacter cloacae、
Klebsiella
aerogenes、Citrobacter
freundii、Serratia
marcescens、Morganella
morganii、
Providencia rettgeri、Hafnia alvei 等がある。
染色体性 AmpC 産生腸内細菌目細菌(以下、染色体性 AmpC 産生菌)感染症の最大の特徴は、
治療前に第 3 世代以下のセファロスポリン系抗菌薬に感受性があったとしても、同剤で治療中に
耐性化してしまい、最終的に治療に失敗する可能性がある、という点である。臨床研究での治療
中の耐性化率は、最大でも約 20%程度 45 であり、また耐性化する(つまり、微生物学的な治療
失敗)ことが、臨床的に治療に失敗するということを意味するわけではない 46。第 3 世代セファ
ロスポリン系抗菌薬に曝露した場合に耐性化するリスクは、前述の染色体性 AmpC 産生菌の菌種
間でも差があり、具体的には E. cloacae、K. aerogenes、C. freundii の 3 菌種ではリスクが高い
一方 47 で、それ以外の菌種では、相対的にリスクが低いか、あるいはリスクがどの程度なのかま
だよく分かっていない。
また、AmpC 遺伝子を染色体にコードしていない Klebsiella pneumoniae、Klebsiella oxytoca、
Proteus mirabilis あるいは染色体にコードしていてもがそれが臨床的に問題となることが殆どな
い Escherichia coli 等の菌種でも、プラスミドを筆頭とする可動遺伝因子を介して、染色体性
AmpC 産生菌由来の AmpC 遺伝子を獲得する場合がある。これらのプラスミド性 AmpC 産生菌
は、原則的に感受性検査では第 3 世代以下のセファロスポリン系抗菌薬に非感受性を示す。
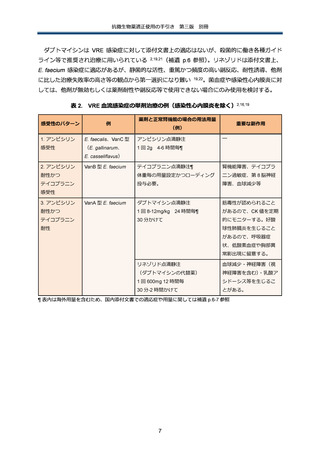
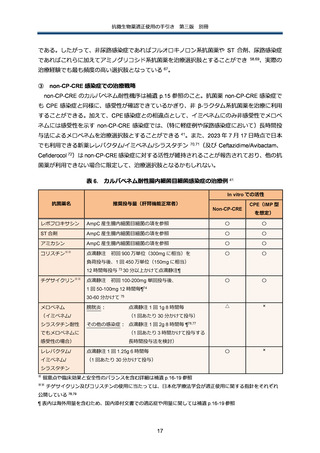
微生物学的診断
プラスミド性に AmpC を産生しうる E. coli, K. pneumoniae、K. oxytoca、P. mirabilis 等の菌種
では、第 3 世代セファロスポリン系抗菌薬に非感受性を示した場合、ESBL との鑑別が必要にな
る。ESBL の場合、セファマイシン系やオキサセフェム系抗菌薬に高度感受性を示す一方で、プ
ラスミド性 AmpC では多くの場合、非感受性を示す。スクリーニング陽性株に対しては、表現型
検査や遺伝子検査にて確認検査を行う(補遺 p.9 参照)
。
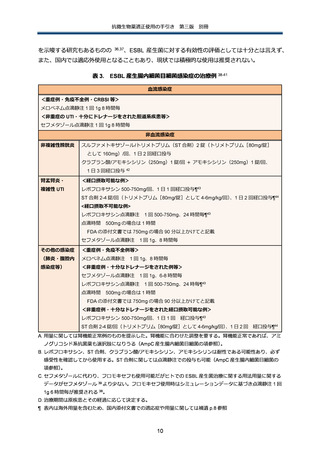
治療方針
染色体性 AmpC 産生菌が第 3 世代セファロスポリン系抗菌薬に感受性を示した場合、前述の
AmpC 過剰産生のリスクが高い E. cloacae、K. aerogenes、C. freundii が原因菌の場合、治療中
の耐性化が懸念される。さらに既存の観察研究は耐性化のみに主眼が置かれており、臨床予後を
評価した研究が極めて限られているため、膀胱炎等軽症の UTI を除いて、第 3 世代セファロスポ
リン系抗菌薬を治療に用いることは推奨されない。
一方で、それ以外の S. marcescens、M. morganii、P. rettgeri、H. alvei 等が原因菌の場合、原
則的に感受性に従った抗菌薬選択が可能である 41。但し、これらの菌種でも、菌量が多く、ドレ
ナージ等による感染巣のコントロールが困難な場合には、感受性であっても第 3 世代セファロス
ポリン系抗菌薬の使用は慎重に検討する必要がある。
11
(iii)
第三版
別冊
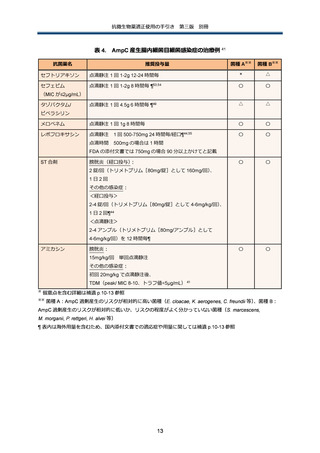
AmpC 産生腸内細菌目細菌
疫学の概要と臨床的特徴
AmpC 遺伝子を染色体にコードする代表的な腸内細菌目細菌としては、Enterobacter cloacae、
Klebsiella
aerogenes、Citrobacter
freundii、Serratia
marcescens、Morganella
morganii、
Providencia rettgeri、Hafnia alvei 等がある。
染色体性 AmpC 産生腸内細菌目細菌(以下、染色体性 AmpC 産生菌)感染症の最大の特徴は、
治療前に第 3 世代以下のセファロスポリン系抗菌薬に感受性があったとしても、同剤で治療中に
耐性化してしまい、最終的に治療に失敗する可能性がある、という点である。臨床研究での治療
中の耐性化率は、最大でも約 20%程度 45 であり、また耐性化する(つまり、微生物学的な治療
失敗)ことが、臨床的に治療に失敗するということを意味するわけではない 46。第 3 世代セファ
ロスポリン系抗菌薬に曝露した場合に耐性化するリスクは、前述の染色体性 AmpC 産生菌の菌種
間でも差があり、具体的には E. cloacae、K. aerogenes、C. freundii の 3 菌種ではリスクが高い
一方 47 で、それ以外の菌種では、相対的にリスクが低いか、あるいはリスクがどの程度なのかま
だよく分かっていない。
また、AmpC 遺伝子を染色体にコードしていない Klebsiella pneumoniae、Klebsiella oxytoca、
Proteus mirabilis あるいは染色体にコードしていてもがそれが臨床的に問題となることが殆どな
い Escherichia coli 等の菌種でも、プラスミドを筆頭とする可動遺伝因子を介して、染色体性
AmpC 産生菌由来の AmpC 遺伝子を獲得する場合がある。これらのプラスミド性 AmpC 産生菌
は、原則的に感受性検査では第 3 世代以下のセファロスポリン系抗菌薬に非感受性を示す。
微生物学的診断
プラスミド性に AmpC を産生しうる E. coli, K. pneumoniae、K. oxytoca、P. mirabilis 等の菌種
では、第 3 世代セファロスポリン系抗菌薬に非感受性を示した場合、ESBL との鑑別が必要にな
る。ESBL の場合、セファマイシン系やオキサセフェム系抗菌薬に高度感受性を示す一方で、プ
ラスミド性 AmpC では多くの場合、非感受性を示す。スクリーニング陽性株に対しては、表現型
検査や遺伝子検査にて確認検査を行う(補遺 p.9 参照)
。
治療方針
染色体性 AmpC 産生菌が第 3 世代セファロスポリン系抗菌薬に感受性を示した場合、前述の
AmpC 過剰産生のリスクが高い E. cloacae、K. aerogenes、C. freundii が原因菌の場合、治療中
の耐性化が懸念される。さらに既存の観察研究は耐性化のみに主眼が置かれており、臨床予後を
評価した研究が極めて限られているため、膀胱炎等軽症の UTI を除いて、第 3 世代セファロスポ
リン系抗菌薬を治療に用いることは推奨されない。
一方で、それ以外の S. marcescens、M. morganii、P. rettgeri、H. alvei 等が原因菌の場合、原
則的に感受性に従った抗菌薬選択が可能である 41。但し、これらの菌種でも、菌量が多く、ドレ
ナージ等による感染巣のコントロールが困難な場合には、感受性であっても第 3 世代セファロス
ポリン系抗菌薬の使用は慎重に検討する必要がある。
11