よむ、つかう、まなぶ。
議題2 別紙2先進医療Bに係る新規技術の科学的評価等について (24 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_48654.html |
| 出典情報 | 先進医療会議(第139回 1/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
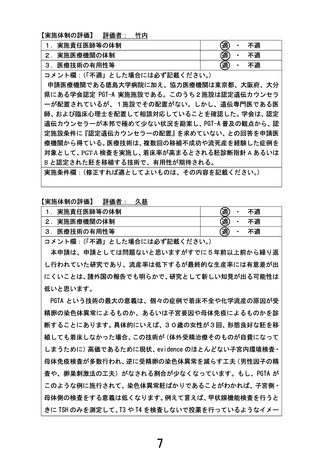
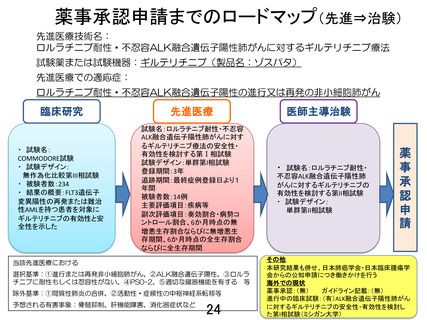
薬事承認申請までのロードマップ(先進⇒治験)
先進医療技術名:
ロルラチニブ耐性・不忍容ALK融合遺伝子陽性肺がんに対するギルテリチニブ療法
試験薬または試験機器:ギルテリチニブ(製品名:ゾスパタ)
先進医療での適応症:
ロルラチニブ耐性・不忍容ALK融合遺伝子陽性の進行又は再発の非小細胞肺がん
臨床研究
先進医療
・ 試験名:
COMMODORE試験
・ 試験デザイン:
無作為化比較第III相試験
・ 被験者数:234
・ 結果の概要:FLT3遺伝子
変異陽性の再発または難治
性AMLを持つ患者を対象に
ギルテリチニブの有効性と安
全性を示した
試験名:ロルラチニブ耐性・不忍容
ALK融合遺伝子陽性肺がんに対す
るギルテリチニブ療法の安全性・
有効性を検討する第Ⅰ相試験
試験デザイン:単群第I相試験
登録期間:3年
追跡期間:最終症例登録日より1
年間
被験者数:14例
主要評価項目:疾病等
副次評価項目:奏効割合・病勢コ
ントロール割合、6か月時点の無
増悪生存割合ならびに無増悪生
存期間、6か月時点の全生存割合
ならびに全生存期間
当該先進医療における
選択基準:①進行または再発非小細胞肺がん、②ALK融合遺伝子陽性、③ロルラ
チニブに耐性もしくは忍容性がない、④PS0-2、⑤適切な臓器機能を有する 等
除外基準:①間質性肺炎の合併、②活動性・症候性の中枢神経系転移等
予想される有害事象:骨髄抑制、肝機能障害、消化器症状など
24
医師主導治験
・ 試験名:ロルラチニブ耐性・
不忍容ALK融合遺伝子陽性肺
がんに対するギルテリチニブの
有効性を検討する第II相試験
・ 試験デザイン:
単群第II相試験
薬
事
承
認
申
請
その他
本研究結果も併せ、日本肺癌学会・日本臨床腫瘍学
会からの公知申請につき働きかけを行う
海外での現状
薬事承認:(無)
ガイドライン記載:(無)
進行中の臨床試験:(有)ALK融合遺伝子陽性肺がん
に対するギルテリチニブの安全性・有効性を検討し
た第I相試験(ミシガン大学)
先進医療技術名:
ロルラチニブ耐性・不忍容ALK融合遺伝子陽性肺がんに対するギルテリチニブ療法
試験薬または試験機器:ギルテリチニブ(製品名:ゾスパタ)
先進医療での適応症:
ロルラチニブ耐性・不忍容ALK融合遺伝子陽性の進行又は再発の非小細胞肺がん
臨床研究
先進医療
・ 試験名:
COMMODORE試験
・ 試験デザイン:
無作為化比較第III相試験
・ 被験者数:234
・ 結果の概要:FLT3遺伝子
変異陽性の再発または難治
性AMLを持つ患者を対象に
ギルテリチニブの有効性と安
全性を示した
試験名:ロルラチニブ耐性・不忍容
ALK融合遺伝子陽性肺がんに対す
るギルテリチニブ療法の安全性・
有効性を検討する第Ⅰ相試験
試験デザイン:単群第I相試験
登録期間:3年
追跡期間:最終症例登録日より1
年間
被験者数:14例
主要評価項目:疾病等
副次評価項目:奏効割合・病勢コ
ントロール割合、6か月時点の無
増悪生存割合ならびに無増悪生
存期間、6か月時点の全生存割合
ならびに全生存期間
当該先進医療における
選択基準:①進行または再発非小細胞肺がん、②ALK融合遺伝子陽性、③ロルラ
チニブに耐性もしくは忍容性がない、④PS0-2、⑤適切な臓器機能を有する 等
除外基準:①間質性肺炎の合併、②活動性・症候性の中枢神経系転移等
予想される有害事象:骨髄抑制、肝機能障害、消化器症状など
24
医師主導治験
・ 試験名:ロルラチニブ耐性・
不忍容ALK融合遺伝子陽性肺
がんに対するギルテリチニブの
有効性を検討する第II相試験
・ 試験デザイン:
単群第II相試験
薬
事
承
認
申
請
その他
本研究結果も併せ、日本肺癌学会・日本臨床腫瘍学
会からの公知申請につき働きかけを行う
海外での現状
薬事承認:(無)
ガイドライン記載:(無)
進行中の臨床試験:(有)ALK融合遺伝子陽性肺がん
に対するギルテリチニブの安全性・有効性を検討し
た第I相試験(ミシガン大学)