よむ、つかう、まなぶ。
議題2 別紙2先進医療Bに係る新規技術の科学的評価等について (33 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_48654.html |
| 出典情報 | 先進医療会議(第139回 1/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
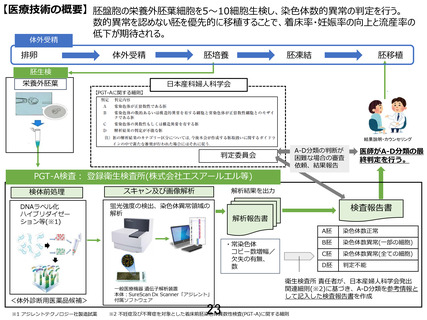
異常等を認める場合には、下記のとおり十分なカウンセリングのもと移植を行うかどうかを決定する。
A 胚が得られず B 胚が得られた場合は、胚移植を行うか否か十分なカウンセリングのもと決定する。
胚移植を行った場合は以後採卵は行わず、胚移植を行わない場合は引き続き採卵を行うことを許容す
る。A 胚および B 胚が得られなければ再度採卵を行うことができる。ただし、胚移植実施集団が予定患
者数に達した後は先進医療としての新規採卵は実施できない。
(2) 移植胚数は単一とする。
5)
妊娠の判定と妊娠経過観察
(1) 血中 hCG を妊娠 4 週 0 日±2 日から妊娠 5 週 0 日±2 日に測定する
(2) 臨床的妊娠は胎嚢確認をもって定義する
6)
性染色体の解析結果の取り扱い
原則として研究責任者及び研究分担者を含む研究機関の医師・カップルには開示しないが、性染色体に
異数、構造異常などを認める場合は、判定を「A」とし、どのような異常が検出されたかについて、コメ
ントを附記して当該の研究機関に送付する。当該胚の移植の可否に関する遺伝カウンセリングは臨床遺
伝専門医などが担当することとし、当該医師が必要と判断した場合は性染色体部分の結果も含めた解析
結果を医師・研究対象者及びパートナーにも開示を許容する。
研究スケジュールと観察・検査項目
1)
同意取得
本研究実施に先立ち、研究責任者又は研究分担者の医師は、倫理審査委員会の承認が得られた説明文書
を用いて研究対象者及びそのパートナーにわかりやすく説明し、本研究の参加について自由意思による
同意を文書で得る。同意取得に際しては、研究対象者及びそのパートナーが日本産科婦人科学会が作成
した着床前染色体検査に関する公開動画を視聴すること
(https://www.jsog.or.jp/modules/committee/index.php?content_id=256)を必須とし、各研究機関
で生殖補助医療と PGT-A に関するカウンセリングを行う。必要に応じて生殖医療専門医へカウンセリン
グを依頼する。また、PGT-A 実施患者において研究対象者及びそのパートナーに開示する情報は判定 A
〜D に関する情報(性染色体に関する情報については下記 4)採卵から終了時までの実施手順及び観
察・検査項目(2)-④に準じる)のみとし、その他ゲノム情報に関しては解析の対象とせず、研究対象者
本人のみならず、家族、そして生まれてくる子に対しても開示しないことを同意取得時に確認する。
研究対象者は、インフォームド・コンセントを与える能力を有した成人のみとし、代諾者によるインフ
ォームド・コンセントは実施しない。
研究対象者及びそのパートナーが説明文書を読むことができないが、口頭または他の伝達方法ではその
内容を理解することができる場合、また利き手麻痺などにより署名が困難な場合等には、公正な立会人
が同意書の署名を代筆することは可能とする。
本人より同意の撤回の申し出があれば、同意撤回書の提出をもって研究への参加を中止する。なお、同
意を撤回しても不利益は生じない。
33
A 胚が得られず B 胚が得られた場合は、胚移植を行うか否か十分なカウンセリングのもと決定する。
胚移植を行った場合は以後採卵は行わず、胚移植を行わない場合は引き続き採卵を行うことを許容す
る。A 胚および B 胚が得られなければ再度採卵を行うことができる。ただし、胚移植実施集団が予定患
者数に達した後は先進医療としての新規採卵は実施できない。
(2) 移植胚数は単一とする。
5)
妊娠の判定と妊娠経過観察
(1) 血中 hCG を妊娠 4 週 0 日±2 日から妊娠 5 週 0 日±2 日に測定する
(2) 臨床的妊娠は胎嚢確認をもって定義する
6)
性染色体の解析結果の取り扱い
原則として研究責任者及び研究分担者を含む研究機関の医師・カップルには開示しないが、性染色体に
異数、構造異常などを認める場合は、判定を「A」とし、どのような異常が検出されたかについて、コメ
ントを附記して当該の研究機関に送付する。当該胚の移植の可否に関する遺伝カウンセリングは臨床遺
伝専門医などが担当することとし、当該医師が必要と判断した場合は性染色体部分の結果も含めた解析
結果を医師・研究対象者及びパートナーにも開示を許容する。
研究スケジュールと観察・検査項目
1)
同意取得
本研究実施に先立ち、研究責任者又は研究分担者の医師は、倫理審査委員会の承認が得られた説明文書
を用いて研究対象者及びそのパートナーにわかりやすく説明し、本研究の参加について自由意思による
同意を文書で得る。同意取得に際しては、研究対象者及びそのパートナーが日本産科婦人科学会が作成
した着床前染色体検査に関する公開動画を視聴すること
(https://www.jsog.or.jp/modules/committee/index.php?content_id=256)を必須とし、各研究機関
で生殖補助医療と PGT-A に関するカウンセリングを行う。必要に応じて生殖医療専門医へカウンセリン
グを依頼する。また、PGT-A 実施患者において研究対象者及びそのパートナーに開示する情報は判定 A
〜D に関する情報(性染色体に関する情報については下記 4)採卵から終了時までの実施手順及び観
察・検査項目(2)-④に準じる)のみとし、その他ゲノム情報に関しては解析の対象とせず、研究対象者
本人のみならず、家族、そして生まれてくる子に対しても開示しないことを同意取得時に確認する。
研究対象者は、インフォームド・コンセントを与える能力を有した成人のみとし、代諾者によるインフ
ォームド・コンセントは実施しない。
研究対象者及びそのパートナーが説明文書を読むことができないが、口頭または他の伝達方法ではその
内容を理解することができる場合、また利き手麻痺などにより署名が困難な場合等には、公正な立会人
が同意書の署名を代筆することは可能とする。
本人より同意の撤回の申し出があれば、同意撤回書の提出をもって研究への参加を中止する。なお、同
意を撤回しても不利益は生じない。
33