よむ、つかう、まなぶ。
議題2 別紙2先進医療Bに係る新規技術の科学的評価等について (34 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_48654.html |
| 出典情報 | 先進医療会議(第139回 1/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2)
研究対象者名簿(対照表)の作成
各施設の研究責任者又は研究分担者の医師は、文書による同意が得られた研究対象者(そのパートナー
含む)に対し、
「研究用識別番号」を付与し、すべての対象者を「研究対象者名簿」に、参加同意取得日、
二次利用同意取得日とともに記録する。
3)
研究対象者の登録
各施設の研究責任者又は研究分担者の医師は、同意が得られた研究対象者の適格性を判断するため、選
択・除外基準に関する情報を本研究の EDC(Electronic Data Capture)システム等へ入力する。入力後、
「適格」と表示された研究対象者は本研究への症例登録例となり、その旨 2)で作成した研究対象者名簿
に記録する。なお、選択・除外基準に関する以下の観察・調査項目の情報(研究対象者の背景情報)は、
通常の ART 診療の過程で得られた情報を入力する。
【研究対象者の背景情報】研究対象者満年齢、パートナー満年齢、生年月日、身長、体重、不妊期間、
ART の適応、既往臨床妊娠回数、生児数、既往流死産回数、既往採卵回数、保険で実施した既往胚移植回
数、既往胚移植で妊娠が成立していない回数、研究対象者及びパートナーの染色体異常の有無
4)
採卵から終了時までの実施手順及び観察・検査項目
(1) 採卵・体外受精(媒精および顕微受精)
・体外培養
臨床研究責任医師又は臨床研究分担医師は、採卵、体外受精(媒精および顕微受精)、体外培養及び受
精卵に関する下記項目について症例報告書に記載する。
【胚培養情報】
PGT-A 検査実施の有無
【PGT-A 実施胚を用いた初回凍結胚移植周期の情報】
移植年月日、移植周期の管理方法、HCG 製剤使用の有無、移植された胚の形態的分類(Gardner 分類等)、
PGT-A 結果の詳細、移植時子宮内膜厚
胚損傷に対する情報:生検操作による胚の損傷、生検後の胚凍結に伴う胚損傷の有無を収集する。
(2) PGT-A
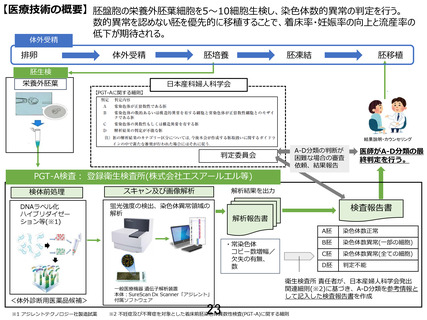
本試験における生検は栄養外胚葉出現時の胚盤胞生検とする。遺伝子解析結果は下記手順に従い、デー
タ分析が均一に行えるよう共有化し評価する。
① 検体は、申請医療機関または協力医療機関で採取したのち衛生検査所(検査受託機関)へ送付し、
解析を行う。
② 検査結果については、日本産科婦人科学会が提示する胚診断指針に沿って検査受託機関が A-D の判
定をつけて検査実施医療機関にフィードバックする。
③ 各研究機関の研究責任者又は研究分担者の医師は、上記判定結果と胚の外観的な特性や発育状態等
の情報をカップルに提供し、相談の上で移植順位を決定する。また、これは、あくまで移植の可否
を考えるにあたり参考にするための判定であり、実際に胚を移植するかしないかに関しては、研究
対象者とそのパートナー(以下、カップル)と担当医師との話し合いの中で、カップルが自律的に
意思決定する。
④ 性染色体の解析結果の取り扱い:原則として研究責任者及び研究分担者を含む研究機関の医師・カ
ップルには開示しないが、性染色体に異数、構造異常などを認める場合は、判定を「A」とし、どの
34
研究対象者名簿(対照表)の作成
各施設の研究責任者又は研究分担者の医師は、文書による同意が得られた研究対象者(そのパートナー
含む)に対し、
「研究用識別番号」を付与し、すべての対象者を「研究対象者名簿」に、参加同意取得日、
二次利用同意取得日とともに記録する。
3)
研究対象者の登録
各施設の研究責任者又は研究分担者の医師は、同意が得られた研究対象者の適格性を判断するため、選
択・除外基準に関する情報を本研究の EDC(Electronic Data Capture)システム等へ入力する。入力後、
「適格」と表示された研究対象者は本研究への症例登録例となり、その旨 2)で作成した研究対象者名簿
に記録する。なお、選択・除外基準に関する以下の観察・調査項目の情報(研究対象者の背景情報)は、
通常の ART 診療の過程で得られた情報を入力する。
【研究対象者の背景情報】研究対象者満年齢、パートナー満年齢、生年月日、身長、体重、不妊期間、
ART の適応、既往臨床妊娠回数、生児数、既往流死産回数、既往採卵回数、保険で実施した既往胚移植回
数、既往胚移植で妊娠が成立していない回数、研究対象者及びパートナーの染色体異常の有無
4)
採卵から終了時までの実施手順及び観察・検査項目
(1) 採卵・体外受精(媒精および顕微受精)
・体外培養
臨床研究責任医師又は臨床研究分担医師は、採卵、体外受精(媒精および顕微受精)、体外培養及び受
精卵に関する下記項目について症例報告書に記載する。
【胚培養情報】
PGT-A 検査実施の有無
【PGT-A 実施胚を用いた初回凍結胚移植周期の情報】
移植年月日、移植周期の管理方法、HCG 製剤使用の有無、移植された胚の形態的分類(Gardner 分類等)、
PGT-A 結果の詳細、移植時子宮内膜厚
胚損傷に対する情報:生検操作による胚の損傷、生検後の胚凍結に伴う胚損傷の有無を収集する。
(2) PGT-A
本試験における生検は栄養外胚葉出現時の胚盤胞生検とする。遺伝子解析結果は下記手順に従い、デー
タ分析が均一に行えるよう共有化し評価する。
① 検体は、申請医療機関または協力医療機関で採取したのち衛生検査所(検査受託機関)へ送付し、
解析を行う。
② 検査結果については、日本産科婦人科学会が提示する胚診断指針に沿って検査受託機関が A-D の判
定をつけて検査実施医療機関にフィードバックする。
③ 各研究機関の研究責任者又は研究分担者の医師は、上記判定結果と胚の外観的な特性や発育状態等
の情報をカップルに提供し、相談の上で移植順位を決定する。また、これは、あくまで移植の可否
を考えるにあたり参考にするための判定であり、実際に胚を移植するかしないかに関しては、研究
対象者とそのパートナー(以下、カップル)と担当医師との話し合いの中で、カップルが自律的に
意思決定する。
④ 性染色体の解析結果の取り扱い:原則として研究責任者及び研究分担者を含む研究機関の医師・カ
ップルには開示しないが、性染色体に異数、構造異常などを認める場合は、判定を「A」とし、どの
34