よむ、つかう、まなぶ。
資料1-3 リオシグアト及びHIVプロテアーゼ阻害剤の電子化された添付文書一覧 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27607.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第10回) |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
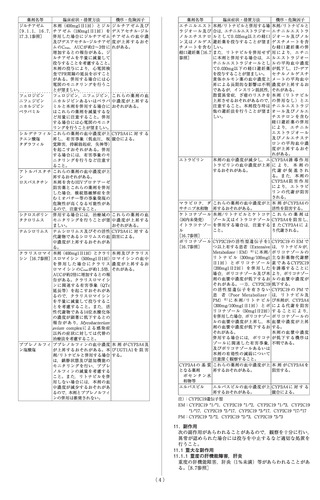
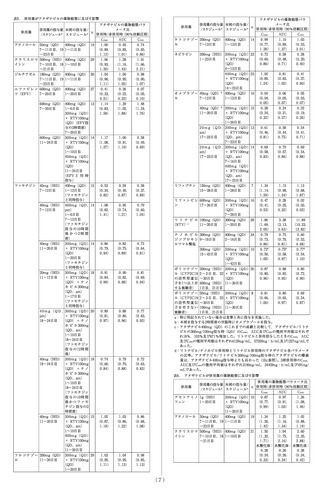
8. 重要な基本的注意
8.1 本剤の投与により肺水腫の徴候がみられた場合には、
肺静脈閉塞性疾患との関連性を疑い、 投与を中止する
こと。[9.1.3参照]
8.2 本剤は血管を拡張して血圧を低下させる作用を有し
ている。 本剤の投与に際しては、 血管拡張作用により
患者が有害な影響を受ける状態(降圧剤投与中、安静時
低血圧、 血液量減少、 重度の左室流出路閉塞、 自律神
経機能障害等)にあるかどうかを十分検討すること。
8.3 臨床試験において、めまい等が認められているので、
高所作業、 自動車の運転等危険を伴う機械を操作する
際には注意させること。
8.4 特発性間質性肺炎に伴う症候性肺高血圧症を対象と
した国際共同試験において、 本剤投与群ではプラセボ
投与群と比較して重篤な有害事象及び死亡が多く認め
られた。 間質性肺病変を伴う肺動脈性肺高血圧症の患
者に本剤を投与する場合は、 間質性肺疾患の治療に精
通した専門医に相談するなど、 本剤投与によるリスク
とベネフィットを考慮した上で、 投与の可否を慎重に
検討すること。[15.1参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 抗凝固療法中の患者
気道出血が起こる可能性が高くなるため、 喀血が起こ
りやすく、 重篤で致死的な喀血の危険性が高まる可能
性がある。 患者ごとに本剤投与のリスク・ ベネフィッ
トを定期的に評価すること。[11.1参照]
9.1.2 投与前の収縮期血圧が95mmHg未満の患者
過度の血圧低下が起こるおそれがある。 本剤の投与に
際しては、 患者における治療上のリスク・ ベネフィッ
トを考慮して慎重に判断すること。 国際共同第Ⅲ相試
験では除外されている。
9.1.3 肺静脈閉塞性疾患の患者
本剤を投与しないことが望ましい。 心血管系の状態を
著しく悪化させるおそれがある。[8.1参照]
9.1.4 喫煙者
禁煙させることが望ましい。 非喫煙者に比べて本剤の
血漿中濃度が低下する。[16.6.1参照]
9.2 腎機能障害患者
9.2.1 重度の腎機能障害患者又は透析中の患者
クレアチニン・クリアランス15mL/min未満の患者又は
透析中の患者には投与しないこと。 血中濃度が著しく
上昇するおそれがある。 国際共同第Ⅲ相試験では除外
されている。[2.4、16.6.2参照]
9.2.2 軽度又は中等度の腎機能障害患者
クレアチニン・クリアランス15~80mL/min未満の患者
では血中濃度が上昇する。[7.1、16.6.2参照]
9.3 肝機能障害患者
9.3.1 重度の肝機能障害患者
Child-Pugh分類Cの患者には投与しないこと。 血中濃
度が著しく上昇するおそれがある。 国際共同第Ⅲ相試
験では除外されている。[2.3参照]
9.3.2 軽度又は中等度の肝機能障害患者
Child-Pugh分類A又はBの患者では血中濃度が上昇す
る。[16.6.3参照]
9.4 生殖能を有する者
妊娠する可能性のある女性に以下について説明及び指
導し、 必要に応じて妊娠検査を行い、 妊娠していない
ことを確認すること。[9.5参照]
・妊娠中に本剤を服用した場合に胎児に影響を及ぼす
危険性があること。
・本剤の服用開始後は確実な避妊法を用いること。
・妊娠した場合若しくはその疑いがある場合には、 直
ちに医師に連絡すること。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しな
いこと。 動物実験において、 ラットで心室中隔欠損、
骨化遅延(胸骨分節)及び全胚吸収がヒトの8.1倍の全身
曝露量で発現することが報告されている1)。また、ウサ
ギで流産及び全胚吸収がそれぞれヒトの3.8倍及び12.6
倍の全身曝露量で発現することが報告されている 2)。
[2.2、9.4参照]
9.6 授乳婦
授乳しないことが望ましい。動物実験(ラット、経口投
与)で乳汁中に投与量の2.2%が移行することが報告され
ている3)。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
血中濃度の上昇が認められている。[16.6.4参照]
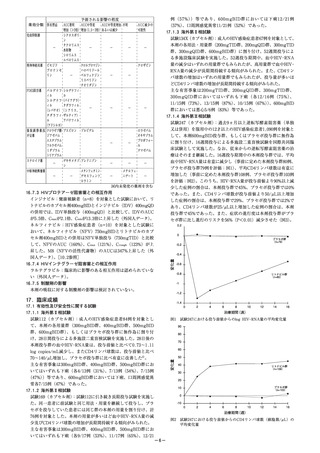
10. 相互作用
本剤は、主にCYP1A1、CYP2C8、CYP2J2及びCYP3A
により代謝される。本剤はP-糖タンパク/乳癌耐性タン
パク(P-gp/BCRP)の基質であるため、これらの阻害薬
若しくは誘導薬により血漿中濃度が影響を受ける可能
性がある。また、本剤及び主代謝物M-1はCYP1A1阻害
作用がある(in vitro )。[7.1参照]
10.1 併用禁忌(併用しないこと)
臨床症状・措置方
薬剤名等
機序・危険因子
法
硝 酸 剤 及 び NO 供 本剤単回投与後に 細 胞 内 cGMP 濃 度
与剤
ニトログリセリン が増加し、 降圧作
ニトログリセリ を舌下投与したと 用を増強する。
ン、 亜硝酸アミ きに、 プラセボ投
ル、 硝酸イソソ 与に比べて有意な
ルビド、 ニコラ 収縮期血圧の低下
ンジル等
が認められている。
[2.5、16.7.1参照]
PDE5阻害剤
症候性低血圧を起 細 胞 内 cGMP 濃 度
シルデナフィル こすことがある。 が増加し、 全身血
ク エ ン 酸 塩(バ
圧に相加的な影響
イアグラ、 レバ
を及ぼすおそれが
チオ)
ある。
タダラフィル
(シ ア リ ス、 ア
ドシルカ、 ザル
ティア)
バルデナフィル
塩酸塩水和物
(レビトラ)
[2.6、16.7.2参照]
アゾール系抗真菌 ケ ト コ ナ ゾ ー ル 複 数 の CYP 分 子
剤
(経口剤: 国内未 種( C Y P 1 A 1 、
イトラコナゾー 発売)との併用に CYP3A 等) 及 び
ル(イ ト リ ゾ ー よ り 本 剤 の AUC P-gp/BCRP阻害に
ル)、 ボ リ コ ナ が 150% 増 加 し、 より本剤のクリア
ゾ ー ル( ブ イ Cmax は 46% 上 昇 ランスが低下する。
フェンド)
した。 また、 消失
[2.7、16.7.3参照]半減期が延長し、
クリアランスも低
下した。
-2-
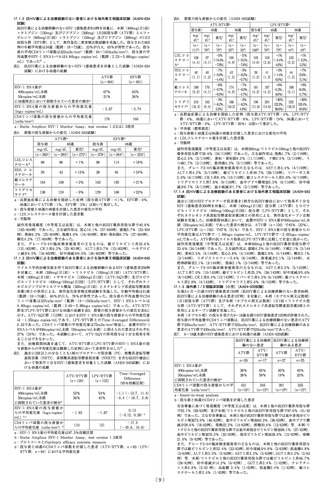
8.1 本剤の投与により肺水腫の徴候がみられた場合には、
肺静脈閉塞性疾患との関連性を疑い、 投与を中止する
こと。[9.1.3参照]
8.2 本剤は血管を拡張して血圧を低下させる作用を有し
ている。 本剤の投与に際しては、 血管拡張作用により
患者が有害な影響を受ける状態(降圧剤投与中、安静時
低血圧、 血液量減少、 重度の左室流出路閉塞、 自律神
経機能障害等)にあるかどうかを十分検討すること。
8.3 臨床試験において、めまい等が認められているので、
高所作業、 自動車の運転等危険を伴う機械を操作する
際には注意させること。
8.4 特発性間質性肺炎に伴う症候性肺高血圧症を対象と
した国際共同試験において、 本剤投与群ではプラセボ
投与群と比較して重篤な有害事象及び死亡が多く認め
られた。 間質性肺病変を伴う肺動脈性肺高血圧症の患
者に本剤を投与する場合は、 間質性肺疾患の治療に精
通した専門医に相談するなど、 本剤投与によるリスク
とベネフィットを考慮した上で、 投与の可否を慎重に
検討すること。[15.1参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 抗凝固療法中の患者
気道出血が起こる可能性が高くなるため、 喀血が起こ
りやすく、 重篤で致死的な喀血の危険性が高まる可能
性がある。 患者ごとに本剤投与のリスク・ ベネフィッ
トを定期的に評価すること。[11.1参照]
9.1.2 投与前の収縮期血圧が95mmHg未満の患者
過度の血圧低下が起こるおそれがある。 本剤の投与に
際しては、 患者における治療上のリスク・ ベネフィッ
トを考慮して慎重に判断すること。 国際共同第Ⅲ相試
験では除外されている。
9.1.3 肺静脈閉塞性疾患の患者
本剤を投与しないことが望ましい。 心血管系の状態を
著しく悪化させるおそれがある。[8.1参照]
9.1.4 喫煙者
禁煙させることが望ましい。 非喫煙者に比べて本剤の
血漿中濃度が低下する。[16.6.1参照]
9.2 腎機能障害患者
9.2.1 重度の腎機能障害患者又は透析中の患者
クレアチニン・クリアランス15mL/min未満の患者又は
透析中の患者には投与しないこと。 血中濃度が著しく
上昇するおそれがある。 国際共同第Ⅲ相試験では除外
されている。[2.4、16.6.2参照]
9.2.2 軽度又は中等度の腎機能障害患者
クレアチニン・クリアランス15~80mL/min未満の患者
では血中濃度が上昇する。[7.1、16.6.2参照]
9.3 肝機能障害患者
9.3.1 重度の肝機能障害患者
Child-Pugh分類Cの患者には投与しないこと。 血中濃
度が著しく上昇するおそれがある。 国際共同第Ⅲ相試
験では除外されている。[2.3参照]
9.3.2 軽度又は中等度の肝機能障害患者
Child-Pugh分類A又はBの患者では血中濃度が上昇す
る。[16.6.3参照]
9.4 生殖能を有する者
妊娠する可能性のある女性に以下について説明及び指
導し、 必要に応じて妊娠検査を行い、 妊娠していない
ことを確認すること。[9.5参照]
・妊娠中に本剤を服用した場合に胎児に影響を及ぼす
危険性があること。
・本剤の服用開始後は確実な避妊法を用いること。
・妊娠した場合若しくはその疑いがある場合には、 直
ちに医師に連絡すること。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しな
いこと。 動物実験において、 ラットで心室中隔欠損、
骨化遅延(胸骨分節)及び全胚吸収がヒトの8.1倍の全身
曝露量で発現することが報告されている1)。また、ウサ
ギで流産及び全胚吸収がそれぞれヒトの3.8倍及び12.6
倍の全身曝露量で発現することが報告されている 2)。
[2.2、9.4参照]
9.6 授乳婦
授乳しないことが望ましい。動物実験(ラット、経口投
与)で乳汁中に投与量の2.2%が移行することが報告され
ている3)。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
血中濃度の上昇が認められている。[16.6.4参照]
10. 相互作用
本剤は、主にCYP1A1、CYP2C8、CYP2J2及びCYP3A
により代謝される。本剤はP-糖タンパク/乳癌耐性タン
パク(P-gp/BCRP)の基質であるため、これらの阻害薬
若しくは誘導薬により血漿中濃度が影響を受ける可能
性がある。また、本剤及び主代謝物M-1はCYP1A1阻害
作用がある(in vitro )。[7.1参照]
10.1 併用禁忌(併用しないこと)
臨床症状・措置方
薬剤名等
機序・危険因子
法
硝 酸 剤 及 び NO 供 本剤単回投与後に 細 胞 内 cGMP 濃 度
与剤
ニトログリセリン が増加し、 降圧作
ニトログリセリ を舌下投与したと 用を増強する。
ン、 亜硝酸アミ きに、 プラセボ投
ル、 硝酸イソソ 与に比べて有意な
ルビド、 ニコラ 収縮期血圧の低下
ンジル等
が認められている。
[2.5、16.7.1参照]
PDE5阻害剤
症候性低血圧を起 細 胞 内 cGMP 濃 度
シルデナフィル こすことがある。 が増加し、 全身血
ク エ ン 酸 塩(バ
圧に相加的な影響
イアグラ、 レバ
を及ぼすおそれが
チオ)
ある。
タダラフィル
(シ ア リ ス、 ア
ドシルカ、 ザル
ティア)
バルデナフィル
塩酸塩水和物
(レビトラ)
[2.6、16.7.2参照]
アゾール系抗真菌 ケ ト コ ナ ゾ ー ル 複 数 の CYP 分 子
剤
(経口剤: 国内未 種( C Y P 1 A 1 、
イトラコナゾー 発売)との併用に CYP3A 等) 及 び
ル(イ ト リ ゾ ー よ り 本 剤 の AUC P-gp/BCRP阻害に
ル)、 ボ リ コ ナ が 150% 増 加 し、 より本剤のクリア
ゾ ー ル( ブ イ Cmax は 46% 上 昇 ランスが低下する。
フェンド)
した。 また、 消失
[2.7、16.7.3参照]半減期が延長し、
クリアランスも低
下した。
-2-