よむ、つかう、まなぶ。
資料1-3 リオシグアト及びHIVプロテアーゼ阻害剤の電子化された添付文書一覧 (24 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27607.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第10回) |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
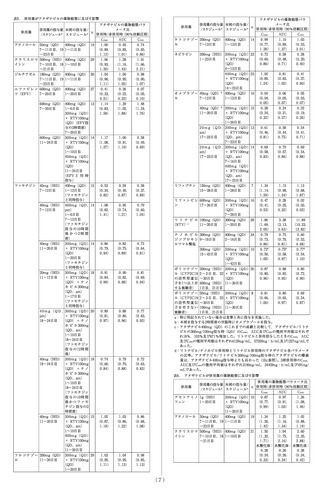
8.1.4 本剤は一部の薬剤と相互作用を起こすことがあるため,
処方箋の有無にかかわらず服用している薬剤をすべて担当医
及び薬剤師に報告すること。
**8.1.5 抗HIV療法による効果的なウイルス抑制は,性的接触に
よる他者へのHIV感染の危険性を低下させることが示されて
いるが,その危険性を完全に排除することはできないこと。
**8.1.6 抗HIV療法が,血液等による他者へのHIV感染の危険性
を低下させるかどうかは証明されていないこと。
8.1.7 無症候性の高ビリルビン血症があらわれることがあるの
で,本剤服用中に眼球・皮膚の黄染がみられた場合には担当
医に報告すること。
8.1.8 本剤の長期投与による影響については,現在のところ不
明であること。
8.2 本剤にて治療中,UDP-グルクロニルトランスフェラーゼ
(UGT)阻害により無症候性の非抱合型ビリルビン上昇が高頻
度にあらわれる。この高ビリルビン血症は本剤投与中止によ
り回復する。高ビリルビン血症とともに肝トランスアミナー
ゼの上昇を認める場合には,他の原因を疑うこと。総ビリル
ビンの正常範囲の上限より5倍を超える上昇が認められた患者
での長期的な安全性データは得られていない。ビリルビン上
昇による黄疸・黄疸眼があらわれ,患者の美容上の観点より,
本剤から他の抗HIV療法への切り換えを考慮することがある。
8.3 本剤の投与による軽・中等度の発疹が報告されている。一般
に投与開始3週間以内に斑状又は丘疹状の発疹が生じ,通常は
投与継続中に2週間以内で消失する。重度の発疹が発現したり,
持続する場合には本剤の投与を中止すること。
[11.1.5参照]
8.4 HIVプロテアーゼ阻害薬にて治療中の患者において糖尿病の
発症や悪化及び高血糖が発現し,その中には糖尿病性ケトアシ
ドーシスを伴っていた症例が市販後調査で報告されている。定
期的に検査を行うなど観察を十分に行うこと。
[11.1.2参照]
8.5 本剤と乳酸アシドーシスの危険性を増大させることが知ら
れているヌクレオシドアナログを併用投与した患者(妊婦を
含む)に,致死性の乳酸アシドーシス及び高乳酸血症が報告
されている。
8.6 本剤を含む抗HIV薬の多剤併用療法を行った患者で,免疫
再構築症候群が報告されている。投与開始後,免疫機能が回
復し,症候性のみならず無症候性日和見感染(マイコバク
テリウムアビウムコンプレックス,サイトメガロウイルス,
ニューモシスチス等によるもの)等に対する炎症反応が発現
することがある。また,免疫機能の回復に伴い自己免疫疾患
(甲状腺機能亢進症,多発性筋炎,ギラン・バレー症候群,ブ
ドウ膜炎等)が発現するとの報告があるので,これらの症状
を評価し,必要時には適切な治療を考慮すること。
8.7 重 度 の 肝 機 能 障 害, 肝 炎 等 が あ ら わ れ る こ と が あ る の
で,定期的に肝機能検査を行うなど観察を十分に行うこと。
[9.1.4,9.3.2,9.3.3,11.1.1参照]
8.8 本剤による治療は,抗HIV療法に十分な経験を持つ医師の
もとで開始すること。
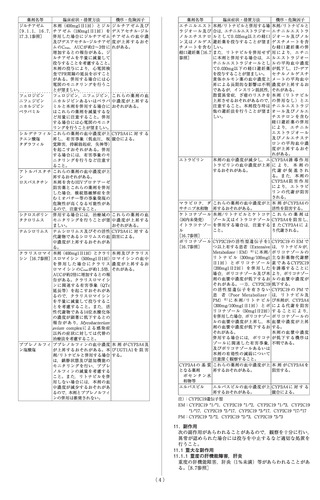
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 心伝導障害(房室ブロック)のある患者
本剤の投与により,心電図検査でPR間隔の延長を示すことが
ある。心伝導障害は第一〜三度AVブロックの報告がある。臨
床試験データが十分でない。[10.2,11.1.4,17.3.1参照]
9.1.2 血友病及び著しい出血傾向を有する患者
HIVプロテアーゼ阻害薬にて治療中の血友病患者において突
発性の出血性関節症をはじめとする出血事象の増加が報告さ
れている。[11.1.3参照]
9.1.3 無酸症等著しい低胃酸状態が持続する状態の患者
無酸症等著しい低胃酸状態が持続する状態では,本剤の血中
濃度が低下し作用が減弱するおそれがある。
9.1.4 B型・C型肝炎の患者
定期的に肝機能検査を行うなど患者の状態をモニタリングす
ること。トランスアミナーゼがさらに上昇する又は肝機能が
悪化するおそれがある。[8.7参照]
9.2 腎機能障害患者
9.2.1 透析を施行している腎障害患者
[7.5,16.6.1参照]
9.3 肝機能障害患者
9.3.1 重度の肝障害のある患者
投与しないこと。血中濃度が上昇すると予想される。[2.2,
16.6.2参照]
9.3.2 投与前に著しいトランスアミナーゼの上昇が認められた
患者
定期的に肝機能検査を行うなど患者の状態をモニタリングす
ること。トランスアミナーゼがさらに上昇する又は肝機能が
悪化するおそれがある。[8.7参照]
9.3.3 軽度~中等度の肝障害のある患者
本剤は主に肝臓で代謝されるため,肝障害のある患者では高
い血中濃度が持続するおそれがある。[7.4,8.7,16.6.2参照]
9.5 妊婦
9.5.1 妊婦又は妊娠している可能性のある女性には,治療上の
有益性が危険性を上回ると判断される場合にのみ投与するこ
と。動物実験(ラット,ウサギ)では,母動物の曝露量が臨
床用量(400mg/日)と同程度(ウサギ)又は2倍(ラット)で
催奇形性は認められなかった。ラットの周産期及び授乳期に
投与すると,母動物に毒性が発現する用量(曝露量で臨床用
量の2倍に相当)で,産児に体重減少又は体重増加抑制が認め
られた。母動物の曝露量がヒトに400mg/日投与した場合の曝
露量と同程度の用量では,産児に対する影響は認められなかっ
た。
9.5.2 分娩前に追加検査及び代替治療の実施を考慮すること。
本剤投与中に高ビリルビン血症が高頻度に発現する。本剤を
妊婦に投与した場合,新生児や乳幼児に生理的高ビリルビン
血症の悪化及び核黄疸の発現がみられるか否かは不明である。
9.6 授乳婦
授乳を避けさせること。乳汁を介してHIV母児感染の可能性が
あること及び本剤の乳汁中への移行により乳児に重篤な有害
事象が発現する可能性がある。動物実験(ラット)で,乳汁中
に移行することが報告されている。また,本剤がヒトの乳汁中
に移行するとの報告がある。
9.7 小児等
9.7.1 新生児,月齢3ヵ月未満の乳児には,核黄疸の発現の危険
性があるので本剤を投与しないこと。[17.1.5参照]
9.7.2 小児等に対する国内臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理
機能(肝機能,腎機能,心機能等)が低下しており,また,
合併症を有し,若しくは他の薬剤を併用している場合が多い。
[16.6.3参照]
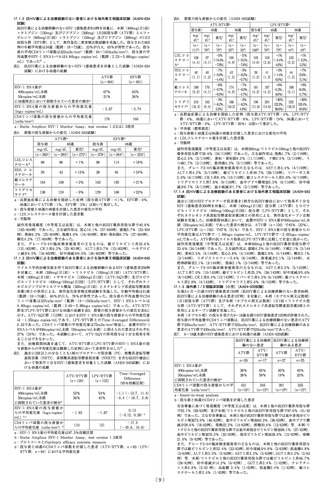
10. 相互作用
本剤はチトクロームP450(CYP3A4)及びUDP-グルクロニル
トランスフェラーゼ(UGT)の阻害作用を有する。[16.7参照]
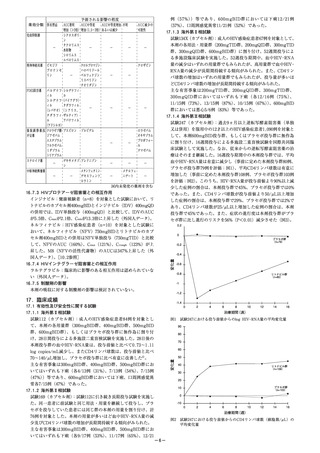
10.1 併用禁忌(併用しないこと)
薬剤名等
臨床症状・措置方法
機序・危険因子
リ フ ァ ン ピ シ 本剤の血中濃度が低下し,本 リ フ ァ ン ピ シ ン が
ン(リファジン)剤の効果が減弱するおそれが CYP3A4 を 誘 導 す
[16.7参照]
ある。
ることによる。
イ リ ノ テ カ ン 塩 イリノテカンの副作用を増強 本 剤 のUGT阻 害 に
酸塩水和物
することがある。
よりイリノテカン
(カンプト,トポ
の代謝が抑制され
テシン)
るおそれがある。
ミ ダ ゾ ラ ム( ド これらの薬剤の代謝が抑制さ CYP3A4 に 対 す る
ルミカム)
れ,重篤な又は生命に危険を 競合による。
トリアゾラム(ハ 及ぼすような事象(持続的又
ルシオン)
は 過 度 の 鎮 静, 呼 吸 抑 制 等 )
が起こる可能性がある。
ベ プ リ ジ ル 塩 酸 重篤な又は生命に危険を及ぼ
塩 水 和 物( ベ プ すような事象が起こる可能性
リコール)
がある。
エ ル ゴ タ ミ ン 酒 これらの薬剤の代謝が抑制さ
石 酸 塩・ 無 水 カ れ,重篤な又は生命に危険を
フ ェ イ ン・ イ ソ 及ぼすような事象(末梢血管
プ ロ ピ ル ア ン チ 収縮,四肢の虚血等を特徴と
ピ リ ン( ク リ ア する急性の毒性作用)が起こ
ミン配合錠)
る可能性がある。
ジヒドロエルゴ
タミンメシル酸
塩
エルゴメトリン
マレイン酸塩(エ
ルゴメトリンF)
メチルエルゴメ
トリンマレイン
酸塩(パルタン)
ピ モ ジ ド( オ ー ピ モ ジ ド の 代 謝 が 抑 制 さ れ,
ラップ)
重篤な又は生命に危険を及ぼ
すような事象(不整脈等)が
起こる可能性がある。
シ ン バ ス タ チ ン これらの薬剤の代謝が抑制さ
(リポバス)
れ,重篤な又は生命に危険を
ロバスタチン(国 及ぼすような事象(横紋筋融
内未発売)
解症を含むミオパチー等)が
起こる可能性がある。
ロ ミ タ ピ ド メ シ 本剤によりロミタピドの血中
ル 酸 塩( ジ ャ ク 濃度が著しく上昇するおそれ
スタピッド)
がある。
(2)
処方箋の有無にかかわらず服用している薬剤をすべて担当医
及び薬剤師に報告すること。
**8.1.5 抗HIV療法による効果的なウイルス抑制は,性的接触に
よる他者へのHIV感染の危険性を低下させることが示されて
いるが,その危険性を完全に排除することはできないこと。
**8.1.6 抗HIV療法が,血液等による他者へのHIV感染の危険性
を低下させるかどうかは証明されていないこと。
8.1.7 無症候性の高ビリルビン血症があらわれることがあるの
で,本剤服用中に眼球・皮膚の黄染がみられた場合には担当
医に報告すること。
8.1.8 本剤の長期投与による影響については,現在のところ不
明であること。
8.2 本剤にて治療中,UDP-グルクロニルトランスフェラーゼ
(UGT)阻害により無症候性の非抱合型ビリルビン上昇が高頻
度にあらわれる。この高ビリルビン血症は本剤投与中止によ
り回復する。高ビリルビン血症とともに肝トランスアミナー
ゼの上昇を認める場合には,他の原因を疑うこと。総ビリル
ビンの正常範囲の上限より5倍を超える上昇が認められた患者
での長期的な安全性データは得られていない。ビリルビン上
昇による黄疸・黄疸眼があらわれ,患者の美容上の観点より,
本剤から他の抗HIV療法への切り換えを考慮することがある。
8.3 本剤の投与による軽・中等度の発疹が報告されている。一般
に投与開始3週間以内に斑状又は丘疹状の発疹が生じ,通常は
投与継続中に2週間以内で消失する。重度の発疹が発現したり,
持続する場合には本剤の投与を中止すること。
[11.1.5参照]
8.4 HIVプロテアーゼ阻害薬にて治療中の患者において糖尿病の
発症や悪化及び高血糖が発現し,その中には糖尿病性ケトアシ
ドーシスを伴っていた症例が市販後調査で報告されている。定
期的に検査を行うなど観察を十分に行うこと。
[11.1.2参照]
8.5 本剤と乳酸アシドーシスの危険性を増大させることが知ら
れているヌクレオシドアナログを併用投与した患者(妊婦を
含む)に,致死性の乳酸アシドーシス及び高乳酸血症が報告
されている。
8.6 本剤を含む抗HIV薬の多剤併用療法を行った患者で,免疫
再構築症候群が報告されている。投与開始後,免疫機能が回
復し,症候性のみならず無症候性日和見感染(マイコバク
テリウムアビウムコンプレックス,サイトメガロウイルス,
ニューモシスチス等によるもの)等に対する炎症反応が発現
することがある。また,免疫機能の回復に伴い自己免疫疾患
(甲状腺機能亢進症,多発性筋炎,ギラン・バレー症候群,ブ
ドウ膜炎等)が発現するとの報告があるので,これらの症状
を評価し,必要時には適切な治療を考慮すること。
8.7 重 度 の 肝 機 能 障 害, 肝 炎 等 が あ ら わ れ る こ と が あ る の
で,定期的に肝機能検査を行うなど観察を十分に行うこと。
[9.1.4,9.3.2,9.3.3,11.1.1参照]
8.8 本剤による治療は,抗HIV療法に十分な経験を持つ医師の
もとで開始すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 心伝導障害(房室ブロック)のある患者
本剤の投与により,心電図検査でPR間隔の延長を示すことが
ある。心伝導障害は第一〜三度AVブロックの報告がある。臨
床試験データが十分でない。[10.2,11.1.4,17.3.1参照]
9.1.2 血友病及び著しい出血傾向を有する患者
HIVプロテアーゼ阻害薬にて治療中の血友病患者において突
発性の出血性関節症をはじめとする出血事象の増加が報告さ
れている。[11.1.3参照]
9.1.3 無酸症等著しい低胃酸状態が持続する状態の患者
無酸症等著しい低胃酸状態が持続する状態では,本剤の血中
濃度が低下し作用が減弱するおそれがある。
9.1.4 B型・C型肝炎の患者
定期的に肝機能検査を行うなど患者の状態をモニタリングす
ること。トランスアミナーゼがさらに上昇する又は肝機能が
悪化するおそれがある。[8.7参照]
9.2 腎機能障害患者
9.2.1 透析を施行している腎障害患者
[7.5,16.6.1参照]
9.3 肝機能障害患者
9.3.1 重度の肝障害のある患者
投与しないこと。血中濃度が上昇すると予想される。[2.2,
16.6.2参照]
9.3.2 投与前に著しいトランスアミナーゼの上昇が認められた
患者
定期的に肝機能検査を行うなど患者の状態をモニタリングす
ること。トランスアミナーゼがさらに上昇する又は肝機能が
悪化するおそれがある。[8.7参照]
9.3.3 軽度~中等度の肝障害のある患者
本剤は主に肝臓で代謝されるため,肝障害のある患者では高
い血中濃度が持続するおそれがある。[7.4,8.7,16.6.2参照]
9.5 妊婦
9.5.1 妊婦又は妊娠している可能性のある女性には,治療上の
有益性が危険性を上回ると判断される場合にのみ投与するこ
と。動物実験(ラット,ウサギ)では,母動物の曝露量が臨
床用量(400mg/日)と同程度(ウサギ)又は2倍(ラット)で
催奇形性は認められなかった。ラットの周産期及び授乳期に
投与すると,母動物に毒性が発現する用量(曝露量で臨床用
量の2倍に相当)で,産児に体重減少又は体重増加抑制が認め
られた。母動物の曝露量がヒトに400mg/日投与した場合の曝
露量と同程度の用量では,産児に対する影響は認められなかっ
た。
9.5.2 分娩前に追加検査及び代替治療の実施を考慮すること。
本剤投与中に高ビリルビン血症が高頻度に発現する。本剤を
妊婦に投与した場合,新生児や乳幼児に生理的高ビリルビン
血症の悪化及び核黄疸の発現がみられるか否かは不明である。
9.6 授乳婦
授乳を避けさせること。乳汁を介してHIV母児感染の可能性が
あること及び本剤の乳汁中への移行により乳児に重篤な有害
事象が発現する可能性がある。動物実験(ラット)で,乳汁中
に移行することが報告されている。また,本剤がヒトの乳汁中
に移行するとの報告がある。
9.7 小児等
9.7.1 新生児,月齢3ヵ月未満の乳児には,核黄疸の発現の危険
性があるので本剤を投与しないこと。[17.1.5参照]
9.7.2 小児等に対する国内臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理
機能(肝機能,腎機能,心機能等)が低下しており,また,
合併症を有し,若しくは他の薬剤を併用している場合が多い。
[16.6.3参照]
10. 相互作用
本剤はチトクロームP450(CYP3A4)及びUDP-グルクロニル
トランスフェラーゼ(UGT)の阻害作用を有する。[16.7参照]
10.1 併用禁忌(併用しないこと)
薬剤名等
臨床症状・措置方法
機序・危険因子
リ フ ァ ン ピ シ 本剤の血中濃度が低下し,本 リ フ ァ ン ピ シ ン が
ン(リファジン)剤の効果が減弱するおそれが CYP3A4 を 誘 導 す
[16.7参照]
ある。
ることによる。
イ リ ノ テ カ ン 塩 イリノテカンの副作用を増強 本 剤 のUGT阻 害 に
酸塩水和物
することがある。
よりイリノテカン
(カンプト,トポ
の代謝が抑制され
テシン)
るおそれがある。
ミ ダ ゾ ラ ム( ド これらの薬剤の代謝が抑制さ CYP3A4 に 対 す る
ルミカム)
れ,重篤な又は生命に危険を 競合による。
トリアゾラム(ハ 及ぼすような事象(持続的又
ルシオン)
は 過 度 の 鎮 静, 呼 吸 抑 制 等 )
が起こる可能性がある。
ベ プ リ ジ ル 塩 酸 重篤な又は生命に危険を及ぼ
塩 水 和 物( ベ プ すような事象が起こる可能性
リコール)
がある。
エ ル ゴ タ ミ ン 酒 これらの薬剤の代謝が抑制さ
石 酸 塩・ 無 水 カ れ,重篤な又は生命に危険を
フ ェ イ ン・ イ ソ 及ぼすような事象(末梢血管
プ ロ ピ ル ア ン チ 収縮,四肢の虚血等を特徴と
ピ リ ン( ク リ ア する急性の毒性作用)が起こ
ミン配合錠)
る可能性がある。
ジヒドロエルゴ
タミンメシル酸
塩
エルゴメトリン
マレイン酸塩(エ
ルゴメトリンF)
メチルエルゴメ
トリンマレイン
酸塩(パルタン)
ピ モ ジ ド( オ ー ピ モ ジ ド の 代 謝 が 抑 制 さ れ,
ラップ)
重篤な又は生命に危険を及ぼ
すような事象(不整脈等)が
起こる可能性がある。
シ ン バ ス タ チ ン これらの薬剤の代謝が抑制さ
(リポバス)
れ,重篤な又は生命に危険を
ロバスタチン(国 及ぼすような事象(横紋筋融
内未発売)
解症を含むミオパチー等)が
起こる可能性がある。
ロ ミ タ ピ ド メ シ 本剤によりロミタピドの血中
ル 酸 塩( ジ ャ ク 濃度が著しく上昇するおそれ
スタピッド)
がある。
(2)