よむ、つかう、まなぶ。
【資料1】次世代医療機器評価指標について (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32218.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和4年度第10回 3/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
93
94
95
96
97
98
99
100
101
102
103
104
105
106
107
108
109
110
111
112
113
114
115
116
117
118
119
120
121
122
123
124
125
126
127
128
129
130
131
132
133
134
135
ク.メンテナンス
ケ.教育システム
最新の臨床ガイドラインを参考に、治療実施者と治療対象者等に分けたシステ
ムを準備して、それぞれの機器安全性と有効性の理解度に応じた教育が実施で
きる体制を整えておくこと。
(2)非臨床試験
試験により得られたデータは、その信頼性が担保される必要があることに十分留意す
ること1。
ア.in vitro 評価
近年、動物試験数の削減が求められている背景を考慮し、in vitro 評価によって充足
可能な事項については、できる限り対応することが望ましい。
システムの構成要素、さらに、それらを統合したシステムについて、それぞれ性
能評価を行うと共に、生じうるリスクへの対策等の妥当性について示すこと。試験
結果の妥当性については、ワーストケースシナリオに基づき、評価すること。装置の
動作パラメータの範囲全体にわたり、システムの特性を評価することによって、動作
限界を示すことができる。システム性能の変化が患者に及ぼす影響と、患者の変化
がシステム性能に及ぼす影響を検討すること。極端な動作が機器と患者(試験装置
等)の両方に与える影響を決定する必要がある。極端な動作とは、最小血流量と最大
血流量、高血圧、低血圧、流量の変化に対する反応、圧力、流入/流出の制限の可能
性等である。システムの特性評価に関連する条件は、ISO 14708-5 附属書 C が参考と
なる。
試験前処理は、滅菌、使用環境の温度及び湿度、振動・落下・圧力等運搬時に生じう
る現象、経年変化に対する安定性、劣化に過敏な場合は劣化試験による結果、植込み
前後に生じうる負荷及びその他の現象等を考慮し、行うこと。
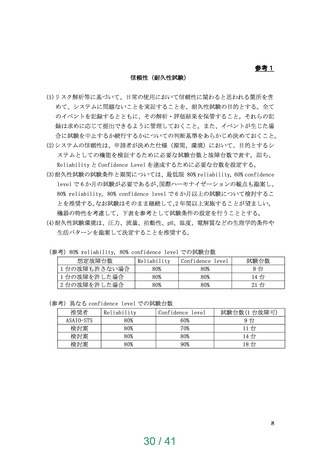
使用目的に応じ耐久性試験を行うこと。(参考 1:信頼性(耐久性試験)
)
以下の各事項について、それぞれ具体的なデータをもって明らかにすること。
(ア) 生物学的安全性(参考:薬生機審発 0106 第 1 号厚生労働省医薬・生活衛生
局医療機器審査管理課長通知、ISO 10993-1 及び JIS T0993-1)
植込型補助人工心臓において重要となる原材料及びシステムの血液適合性
については、ISO 10993-4 や薬生機審発 0106 第 1 号厚生労働省医薬・生活
衛生局医療機器審査管理課長通知「医療機器の製造販売承認申請等に必要
な生物学的安全性評価の基本的考え方についての改正について」の別添を
参考に評価すること。
なお、最終製品となるシステムにおける溶血性試験の考え方については、上
述した ISO 及び通知に加え、ASTM F1841 が参考となる。
(イ) 安定性(なお、放射線滅菌によるものについては、最大線量を踏まえた妥当
な試験検体を使用した材質劣化に関する試験等(参考:平成 30 年 2 月 28 日
付け薬生機審発 0228 第 7 号厚生労働省医薬・生活衛生局医療機器審査管理
課長通知「
「医療機器の製造販売承認申請書添付資料の作成に際し留意すべ
き事項について」の一部改正について」、平成 30 年 2 月 28 日付け薬生機審
発 0228 第 10 号厚生労働省医薬・生活衛生局医療機器審査管理課長通知「滅
1
「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行規則」
(昭和 36 年厚生省令第
1 号)の第 114 条の 22(申請資料の信頼性の基準)
3
11 / 41
94
95
96
97
98
99
100
101
102
103
104
105
106
107
108
109
110
111
112
113
114
115
116
117
118
119
120
121
122
123
124
125
126
127
128
129
130
131
132
133
134
135
ク.メンテナンス
ケ.教育システム
最新の臨床ガイドラインを参考に、治療実施者と治療対象者等に分けたシステ
ムを準備して、それぞれの機器安全性と有効性の理解度に応じた教育が実施で
きる体制を整えておくこと。
(2)非臨床試験
試験により得られたデータは、その信頼性が担保される必要があることに十分留意す
ること1。
ア.in vitro 評価
近年、動物試験数の削減が求められている背景を考慮し、in vitro 評価によって充足
可能な事項については、できる限り対応することが望ましい。
システムの構成要素、さらに、それらを統合したシステムについて、それぞれ性
能評価を行うと共に、生じうるリスクへの対策等の妥当性について示すこと。試験
結果の妥当性については、ワーストケースシナリオに基づき、評価すること。装置の
動作パラメータの範囲全体にわたり、システムの特性を評価することによって、動作
限界を示すことができる。システム性能の変化が患者に及ぼす影響と、患者の変化
がシステム性能に及ぼす影響を検討すること。極端な動作が機器と患者(試験装置
等)の両方に与える影響を決定する必要がある。極端な動作とは、最小血流量と最大
血流量、高血圧、低血圧、流量の変化に対する反応、圧力、流入/流出の制限の可能
性等である。システムの特性評価に関連する条件は、ISO 14708-5 附属書 C が参考と
なる。
試験前処理は、滅菌、使用環境の温度及び湿度、振動・落下・圧力等運搬時に生じう
る現象、経年変化に対する安定性、劣化に過敏な場合は劣化試験による結果、植込み
前後に生じうる負荷及びその他の現象等を考慮し、行うこと。
使用目的に応じ耐久性試験を行うこと。(参考 1:信頼性(耐久性試験)
)
以下の各事項について、それぞれ具体的なデータをもって明らかにすること。
(ア) 生物学的安全性(参考:薬生機審発 0106 第 1 号厚生労働省医薬・生活衛生
局医療機器審査管理課長通知、ISO 10993-1 及び JIS T0993-1)
植込型補助人工心臓において重要となる原材料及びシステムの血液適合性
については、ISO 10993-4 や薬生機審発 0106 第 1 号厚生労働省医薬・生活
衛生局医療機器審査管理課長通知「医療機器の製造販売承認申請等に必要
な生物学的安全性評価の基本的考え方についての改正について」の別添を
参考に評価すること。
なお、最終製品となるシステムにおける溶血性試験の考え方については、上
述した ISO 及び通知に加え、ASTM F1841 が参考となる。
(イ) 安定性(なお、放射線滅菌によるものについては、最大線量を踏まえた妥当
な試験検体を使用した材質劣化に関する試験等(参考:平成 30 年 2 月 28 日
付け薬生機審発 0228 第 7 号厚生労働省医薬・生活衛生局医療機器審査管理
課長通知「
「医療機器の製造販売承認申請書添付資料の作成に際し留意すべ
き事項について」の一部改正について」、平成 30 年 2 月 28 日付け薬生機審
発 0228 第 10 号厚生労働省医薬・生活衛生局医療機器審査管理課長通知「滅
1
「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行規則」
(昭和 36 年厚生省令第
1 号)の第 114 条の 22(申請資料の信頼性の基準)
3
11 / 41