よむ、つかう、まなぶ。
【資料1】次世代医療機器評価指標について (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32218.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和4年度第10回 3/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
植込型補助人工心臓システムのリスクマネジメントや警告
/アラームの設定等について規格を参照して実施すること
に留意し、それらに関する情報提示を行うことを明記。
BTT/DTの両方を目的とした植込型補助人工心臓が対象で
あることを明記(従来通りだが、今回はDTを一層考慮)。
「重症心不全に対する植込型補助人工心臓治療ガイドライ
ン」を引用する形とし、将来の修正等を考慮してその改訂
年も合わせて本指標案の文中に明記。
植込型補助人工心臓に関する評価指標(案)の概要
(注:赤字は旧評価指標から内容に明らかな変更がある項目)
<植込型補助人工心臓に関する
評価指標(案)>
1.はじめに
2.用語の定義
3.本評価指標の対象
4.評価指標の位置づけ
5.評価にあたって留意すべき事項
(1) 基本的事項
(2) 非臨床試験
ア. In vitro評価
イ. In vivo評価
(3) 臨床評価に関わる事項
ア. 基本的な考え方
イ. 臨床試験の実施にあたって
ウ. 臨床試験計画書
(4) 治療管理プログラム
(5) 市販後の実施体制及び
安全対策
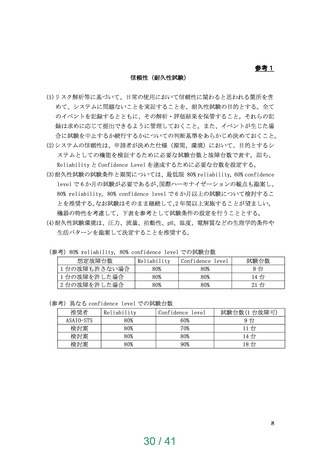
参考 1 信頼性(耐久性試験)
参考 2 動物実験の例数と期間
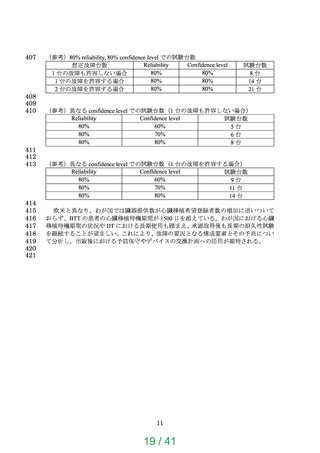
BTTで6ヶ月、DTで2年間の耐久性を示すこと、耐久性
試験は国際整合の観点で一定の条件をクリアすることの推
奨を明記。動物実験の例数及び期間の推奨内容は変更なし。
市販後の安全対策に配慮することを改めて明記。
新規の植込型補助人工心臓は、非臨床試験の結果のみでは
ヒトでの有効性・安全性の担保が困難であり臨床試験によ
る評価が原則必要であるが、RWDの活用や迅速な臨床導
入に向けた承認制度等の活用についても考慮するよう明記。
In vitro評価では各評価項目について確認すべき事項を具
体的に明記し、参照すべき規格や通知についても明記。
In vivo評価では従来の項目を踏襲。
8 / 41
/アラームの設定等について規格を参照して実施すること
に留意し、それらに関する情報提示を行うことを明記。
BTT/DTの両方を目的とした植込型補助人工心臓が対象で
あることを明記(従来通りだが、今回はDTを一層考慮)。
「重症心不全に対する植込型補助人工心臓治療ガイドライ
ン」を引用する形とし、将来の修正等を考慮してその改訂
年も合わせて本指標案の文中に明記。
植込型補助人工心臓に関する評価指標(案)の概要
(注:赤字は旧評価指標から内容に明らかな変更がある項目)
<植込型補助人工心臓に関する
評価指標(案)>
1.はじめに
2.用語の定義
3.本評価指標の対象
4.評価指標の位置づけ
5.評価にあたって留意すべき事項
(1) 基本的事項
(2) 非臨床試験
ア. In vitro評価
イ. In vivo評価
(3) 臨床評価に関わる事項
ア. 基本的な考え方
イ. 臨床試験の実施にあたって
ウ. 臨床試験計画書
(4) 治療管理プログラム
(5) 市販後の実施体制及び
安全対策
参考 1 信頼性(耐久性試験)
参考 2 動物実験の例数と期間
BTTで6ヶ月、DTで2年間の耐久性を示すこと、耐久性
試験は国際整合の観点で一定の条件をクリアすることの推
奨を明記。動物実験の例数及び期間の推奨内容は変更なし。
市販後の安全対策に配慮することを改めて明記。
新規の植込型補助人工心臓は、非臨床試験の結果のみでは
ヒトでの有効性・安全性の担保が困難であり臨床試験によ
る評価が原則必要であるが、RWDの活用や迅速な臨床導
入に向けた承認制度等の活用についても考慮するよう明記。
In vitro評価では各評価項目について確認すべき事項を具
体的に明記し、参照すべき規格や通知についても明記。
In vivo評価では従来の項目を踏襲。
8 / 41