よむ、つかう、まなぶ。
【資料4】医薬局からの定期報告[2.0MB] (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
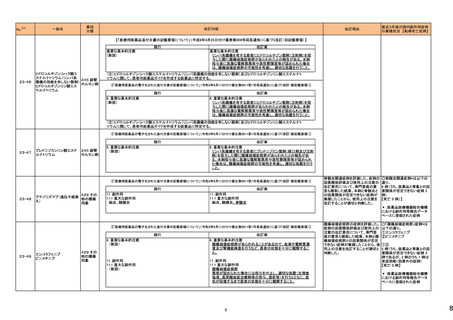
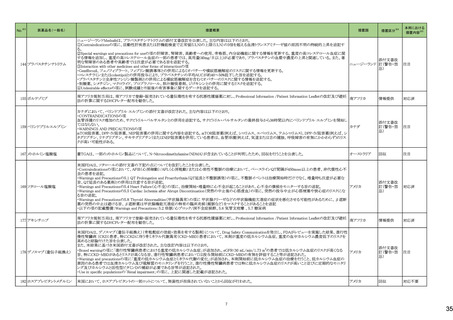
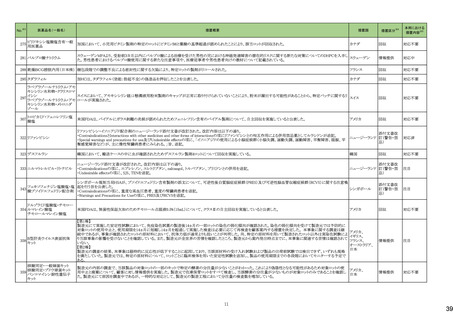
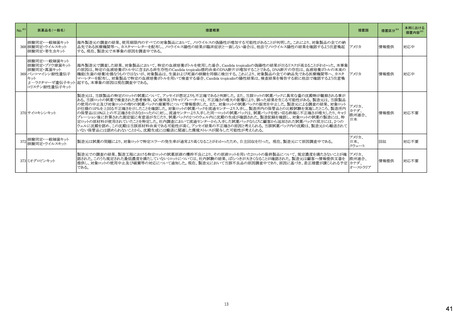
No.※2
一般名
薬効
分類
改訂内容
改訂理由
直近3年度の国内副作用症例
の集積状況 【転帰死亡症例】
令和6年4月9日発出
令和5年度第16回安全対策調査会 ―
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂(新記載要領)】 (令和6年3月26日開催)における議
24-01 ビソプロロールフマル酸塩
212 不整
脈用剤
現行
改訂案
2. 禁忌(次の患者には投与しないこと)
2. 禁忌(次の患者には投与しないこと)
妊婦又は妊娠している可能性のある女性
(削除)
9. 特定の背景を有する患者に関する注意
9. 特定の背景を有する患者に関する注意
9.5 妊婦
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。動
妊婦又は妊娠している可能性のある女性には、治療上の有益性
物実験(ラット、ウサギ)で胎児毒性(致死、発育抑制)及び新生児 が危険性を上回ると判断される場合にのみ投与すること。投与に
毒性(発育毒性等)が報告されている。
際しては、母体及び胎児の状態を十分に観察すること。また、出
生後も新生児の状態を十分に観察し、新生児の低血糖、徐脈、
哺乳不良等の異常が認められた場合には適切な処置を行うこ
と。
妊婦にβ遮断薬を投与した場合に、胎児の発育不全、新生児の
低血糖、徐脈、哺乳不良等が認められたとの報告がある。また、
動物実験 (ラット、ウサギ)で胎児毒性(致死、発育抑制)及び新
生児毒性(発育毒性等)が報告されている(安全域注):ラット胎児
で58倍、ウサギ胎児で39倍、ラット新生児で19倍)。
注)本剤の最大臨床用量の5 mgと動物試験における体表面積換
算した無毒性量(体表面積換算に基づくヒト等価用量)との比較
による。
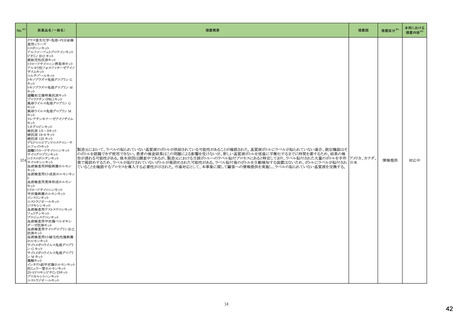
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂(新記載要領)】
24-02 ビソプロロール
214 血圧
降下剤
論結果等を踏まえ、医薬品の「使用
上の注意」を改訂することが適切と
判断した。
24-01と同じ
―
現行
改訂案
2. 禁忌(次の患者には投与しないこと)
2. 禁忌(次の患者には投与しないこと)
妊婦又は妊娠している可能性のある女性
(削除)
9. 特定の背景を有する患者に関する注意
9. 特定の背景を有する患者に関する注意
9.5 妊婦
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。動
妊婦又は妊娠している可能性のある女性には、治療上の有益性
物実験(ラット)で胎児毒性(致死、発育抑制)及び新生児毒性(発 が危険性を上回ると判断される場合にのみ投与すること。投与に
育毒性等)が報告されている。
際しては、母体及び胎児の状態を十分に観察すること。また、出
生後も新生児の状態を十分に観察し、新生児の低血糖、徐脈、
哺乳不良等の異常が認められた場合には適切な処置を行うこ
と。
妊婦にβ遮断薬を投与した場合に、胎児の発育不全、新生児の
低血糖、徐脈、哺乳不良等が認められたとの報告がある。また、
動物実験(ラット、ウサギ)で胎児毒性(致死、発育抑制)及び新生
児毒性(発育毒性等)が報告されている(安全域注):ラット胎児で
58倍、ウサギ胎児で39倍、ラット新生児で19倍)。
注)ビソプロロールフマル酸塩の最大臨床用量の5mgと動物試験
における体表面積換算した無毒性量(体表面積換算に基づくヒト
等価用量)との比較による。
2
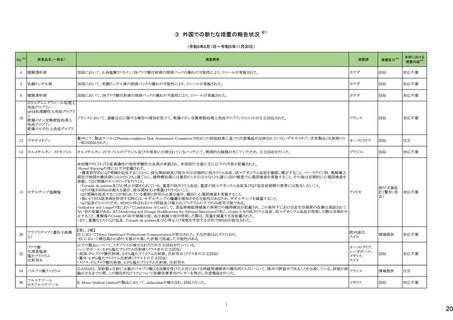
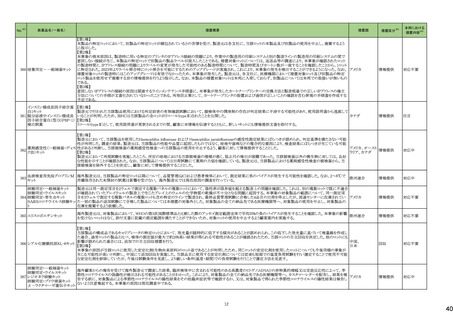
12
一般名
薬効
分類
改訂内容
改訂理由
直近3年度の国内副作用症例
の集積状況 【転帰死亡症例】
令和6年4月9日発出
令和5年度第16回安全対策調査会 ―
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂(新記載要領)】 (令和6年3月26日開催)における議
24-01 ビソプロロールフマル酸塩
212 不整
脈用剤
現行
改訂案
2. 禁忌(次の患者には投与しないこと)
2. 禁忌(次の患者には投与しないこと)
妊婦又は妊娠している可能性のある女性
(削除)
9. 特定の背景を有する患者に関する注意
9. 特定の背景を有する患者に関する注意
9.5 妊婦
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。動
妊婦又は妊娠している可能性のある女性には、治療上の有益性
物実験(ラット、ウサギ)で胎児毒性(致死、発育抑制)及び新生児 が危険性を上回ると判断される場合にのみ投与すること。投与に
毒性(発育毒性等)が報告されている。
際しては、母体及び胎児の状態を十分に観察すること。また、出
生後も新生児の状態を十分に観察し、新生児の低血糖、徐脈、
哺乳不良等の異常が認められた場合には適切な処置を行うこ
と。
妊婦にβ遮断薬を投与した場合に、胎児の発育不全、新生児の
低血糖、徐脈、哺乳不良等が認められたとの報告がある。また、
動物実験 (ラット、ウサギ)で胎児毒性(致死、発育抑制)及び新
生児毒性(発育毒性等)が報告されている(安全域注):ラット胎児
で58倍、ウサギ胎児で39倍、ラット新生児で19倍)。
注)本剤の最大臨床用量の5 mgと動物試験における体表面積換
算した無毒性量(体表面積換算に基づくヒト等価用量)との比較
による。
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂(新記載要領)】
24-02 ビソプロロール
214 血圧
降下剤
論結果等を踏まえ、医薬品の「使用
上の注意」を改訂することが適切と
判断した。
24-01と同じ
―
現行
改訂案
2. 禁忌(次の患者には投与しないこと)
2. 禁忌(次の患者には投与しないこと)
妊婦又は妊娠している可能性のある女性
(削除)
9. 特定の背景を有する患者に関する注意
9. 特定の背景を有する患者に関する注意
9.5 妊婦
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。動
妊婦又は妊娠している可能性のある女性には、治療上の有益性
物実験(ラット)で胎児毒性(致死、発育抑制)及び新生児毒性(発 が危険性を上回ると判断される場合にのみ投与すること。投与に
育毒性等)が報告されている。
際しては、母体及び胎児の状態を十分に観察すること。また、出
生後も新生児の状態を十分に観察し、新生児の低血糖、徐脈、
哺乳不良等の異常が認められた場合には適切な処置を行うこ
と。
妊婦にβ遮断薬を投与した場合に、胎児の発育不全、新生児の
低血糖、徐脈、哺乳不良等が認められたとの報告がある。また、
動物実験(ラット、ウサギ)で胎児毒性(致死、発育抑制)及び新生
児毒性(発育毒性等)が報告されている(安全域注):ラット胎児で
58倍、ウサギ胎児で39倍、ラット新生児で19倍)。
注)ビソプロロールフマル酸塩の最大臨床用量の5mgと動物試験
における体表面積換算した無毒性量(体表面積換算に基づくヒト
等価用量)との比較による。
2
12