よむ、つかう、まなぶ。
【資料4】医薬局からの定期報告[2.0MB] (24 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
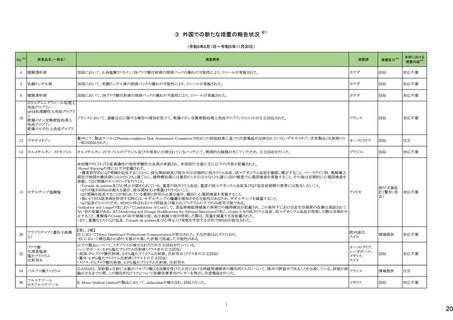
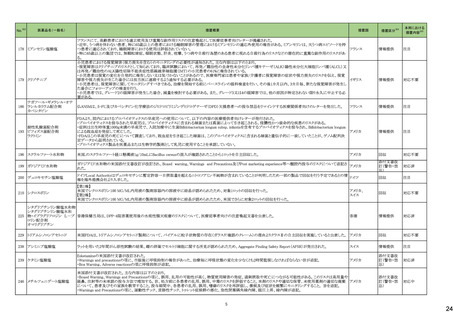
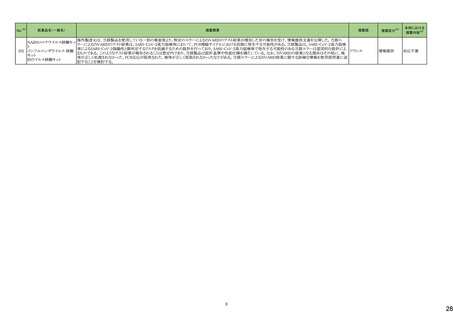
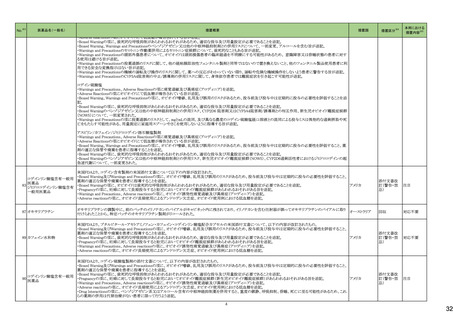
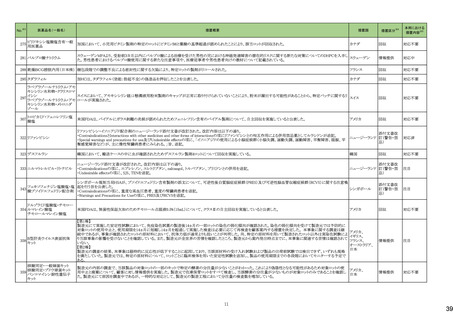
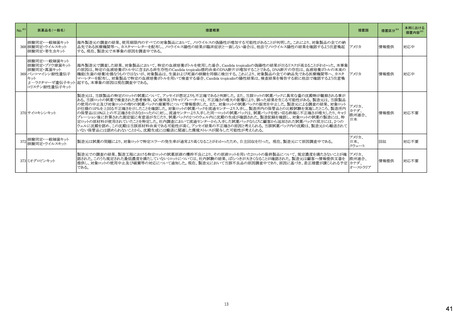
No.※2
医薬品名(一般名)
178 ミアンセリン塩酸塩
179 クリゾチニブ
措置概要
措置国
フランスにて、高齢患者における適正使用及び重篤な副作用リスクの注意喚起として医療従事者向けレターが掲載された。
・近年、うつ病を伴わない患者、特に65歳以上の患者における睡眠障害の管理におけるミアンセリンの適応外使用の報告がある。ミアンセリンは、大うつ病エピソードを持
つ患者に適応されており、睡眠障害における使用は評価されていない。
フランス
・特に65歳以上の集団では、無顆粒球症、傾眠状態、肝炎、痙攣、うつ病や自殺行為歴のある患者に現れる自殺行為のリスクなどの潜在的に重篤な副作用のリスクがあ
る。
小児患者における視覚障害(視力喪失を含む)のモニタリングの必要性が通知された。主な内容は以下のとおり。
・視覚障害はクリゾチニブのリスクとして知られており、臨床試験において、再発/難治性の全身性未分化リンパ腫キナーゼ(ALK)陽性未分化大細胞リンパ腫(ALCL)又
は再発/難治性のALK陽性切除不能炎症性筋線維芽細胞腫(IMT)の小児患者の61%に報告されている。
・小児患者は視覚の変化を自発的に報告しない又は気づかないことがあるので、医療専門家は患者や家族/介護者に視覚障害の症状や視力喪失のリスクを伝え、視覚
障害や視力喪失が生じた場合には担当医に連絡するよう通知する必要がある。
イギリス
・小児患者は、視覚障害に関してモニタリングすべきである。治療を開始する前にベースラインの眼科検査を行い、その後1カ月以内、3カ月毎、新たな視覚障害が発生し
た場合にフォローアップの検査を行う。
・小児患者では、グレード2の眼障害が発生した場合、減量を検討する必要がある。また、グレード3又は4の眼障害では、他の原因が特定されない限り永久に中止する必
要がある。
措置区分※4
本邦における
措置内容※5
情報提供
注目
情報提供
対応不要
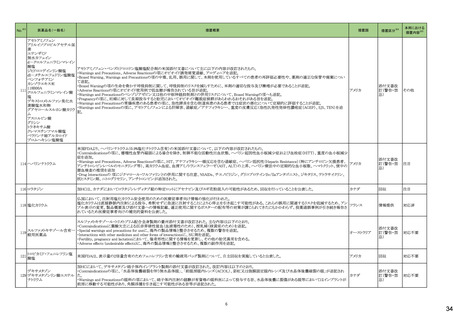
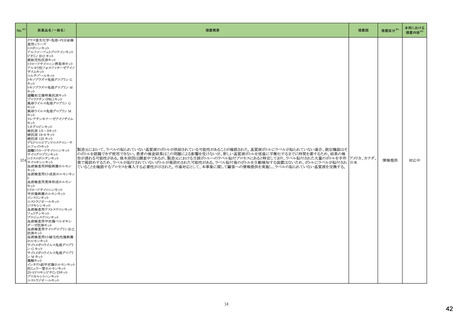
テガフール・ギメラシル・オテ
186 ラシルカリウム配合剤
カペシタビン
仏ANSMは、5-FU及びカペシタビン化学療法のジヒドロピリミジンデヒドロゲナーゼ(DPD)欠損患者への投与禁忌をリマインドする医療関係者向けのレターを発出した。
フランス
情報提供
注目
耐性乳酸菌配合剤
193 ビフィズス菌配合剤
ラクトミン
FDAより、院内におけるプロバイオティクスの早産児への使用について、以下の内容の医療提供者向けレターが発行された。
・プロバイオティクスを投与された早産児は、プロバイオティクスに含まれる細菌または真菌によって引き起こされる、侵襲性かつ致命的な疾患のリスクがある。
・症例は出生時体重1000g未満の早産児で、入院加療中に生菌Bifidobacterium longum subsp. infantisを含有するプロバイオティクスを投与され、Bifidobacterium longum
による敗血症を発症して死亡した。
アメリカ
・FDAはこの早産児の死亡について調査しており、敗血症を引き起こした細菌は、このプロバイオティクスに含まれる細菌と遺伝子的に一致していたことが、ゲノム配列決
定データから証明されている。
・プロバイオティクス製品を医薬品または生物学的製剤として乳児に使用することを承認していない。
情報提供
注目
196 スクラルファート水和物
米国.のスクラルファート経口懸濁液1g/10mLにBacillus cereusの混入が確認されたことから1ロットを自主回収した。
回収
対応不要
199 ガドジアミド水和物
ガドジアミド水和物の米国添付文書改訂が改訂され、Boxed warning、Warnings and Precautions及びPost marketing experience等へ髄腔内投与のリスクについて追記さ
アメリカ
れた。
添付文書改
訂(警告・禁
忌)
対応済
200 デュロキセチン塩酸塩
ドイツLocal Authorityはデュロキセチンに暫定許容一日摂取量を超えるニトロソアミン不純物が含まれていることが判明したため一部の製品で回収を行う予定であるとの情
ドイツ
報を海外提携会社より入手した。
回収
注目
210 シクロスポリン
【第1報】
米国でシクロスポリン100 MG/ML内用液の製剤容器内の溶液中に結晶が認められたため、対象1ロットの回収を行った。
【第2報】
米国でシクロスポリン100 MG/ML内用液の製剤容器内の溶液中に結晶が認められたため、米国でさらに対象2ロットの回収を行った。
アメリカ、
スイス
回収
対応不要
香港
情報提供
対応済
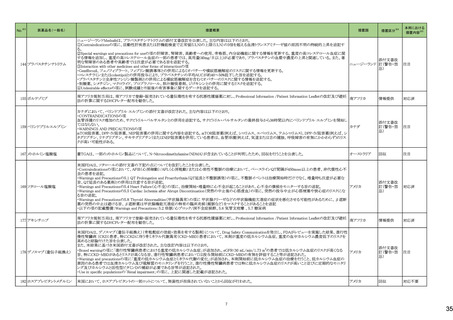
シタグリプチンリン酸塩水和物
シタグリプチンリン酸塩水和
225 物・イプラグリフロジン L-プ 香港保健当局は、DPP-4阻害薬使用後の水疱性類天疱瘡のリスクについて、医療従事者向けの注意喚起文書を公表した。
ロリン配合剤
オマリグリプチン
アメリカ
229 トリアムシノロンアセトニド
米国FDAは、トリアムシノロンアセトニド製剤について、バイアルに粒子状物質の存在(ガラス片確認のクレーム)の理由よりクラスⅡの自主回収を実施していると公表した。 アメリカ
回収
対応不要
238 アシミニブ塩酸塩
ラットを用いた2年間がん原性試験の結果、雌の卵巣でセルトリ細胞に関する所見が認められたため、Aggregate Finding Safety Report(AFSR)が発出された。
スイス
情報提供
注目
239 ケタミン塩酸塩
Esketamineの米国添付文書が改訂された。
・Warnings and precautionsの項に、市販後に呼吸抑制の報告があった、治療毎に呼吸状態の変化を少なくとも2時間監視しなければならない旨が追記。
・Box Warning、Adverse reactionsの項に呼吸抑制が追記。
アメリカ
添付文書改
訂(警告・禁
忌)
対応済
246 メチルフェニデート塩酸塩
米国添付文書が改訂された。主な内容は以下のとおり。
・Boxed Warning、Warnings and Precautionsの項に、誤用、乱用の可能性が高く、物質使用障害の発症、過剰摂取や死亡につながる可能性がある。このリスクは高用量や
経鼻、注射等の未承認の投与方法で増加する。旨、処方前に各患者の乱用、誤用、中毒のリスクを評価すること。本剤のリスクや適切な保管、未使用薬剤の適切な廃棄 アメリカ
について、患者及びその家族を教育すること。投与期間中、各患者の乱用、誤用、嗜癖のリスクを再評価し、徴候及び症状を頻繁にモニタリングすること。 旨を追記。
・Warnings and Precautionsの項に、運動性チック、言語性チック、トゥレット症候群の悪化、急性閉塞隅角緑内障、眼圧上昇、緑内障が追記。
添付文書改
訂(警告・禁
忌)
対応中
5
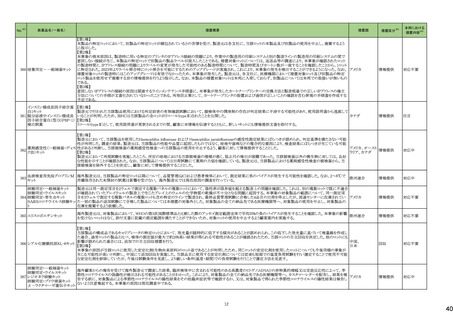
24
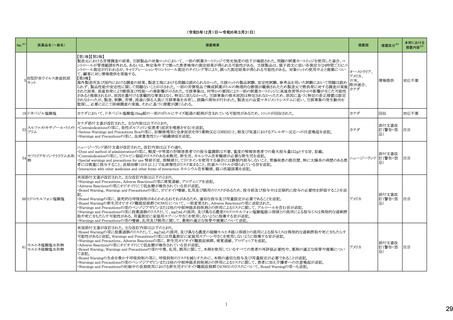
医薬品名(一般名)
178 ミアンセリン塩酸塩
179 クリゾチニブ
措置概要
措置国
フランスにて、高齢患者における適正使用及び重篤な副作用リスクの注意喚起として医療従事者向けレターが掲載された。
・近年、うつ病を伴わない患者、特に65歳以上の患者における睡眠障害の管理におけるミアンセリンの適応外使用の報告がある。ミアンセリンは、大うつ病エピソードを持
つ患者に適応されており、睡眠障害における使用は評価されていない。
フランス
・特に65歳以上の集団では、無顆粒球症、傾眠状態、肝炎、痙攣、うつ病や自殺行為歴のある患者に現れる自殺行為のリスクなどの潜在的に重篤な副作用のリスクがあ
る。
小児患者における視覚障害(視力喪失を含む)のモニタリングの必要性が通知された。主な内容は以下のとおり。
・視覚障害はクリゾチニブのリスクとして知られており、臨床試験において、再発/難治性の全身性未分化リンパ腫キナーゼ(ALK)陽性未分化大細胞リンパ腫(ALCL)又
は再発/難治性のALK陽性切除不能炎症性筋線維芽細胞腫(IMT)の小児患者の61%に報告されている。
・小児患者は視覚の変化を自発的に報告しない又は気づかないことがあるので、医療専門家は患者や家族/介護者に視覚障害の症状や視力喪失のリスクを伝え、視覚
障害や視力喪失が生じた場合には担当医に連絡するよう通知する必要がある。
イギリス
・小児患者は、視覚障害に関してモニタリングすべきである。治療を開始する前にベースラインの眼科検査を行い、その後1カ月以内、3カ月毎、新たな視覚障害が発生し
た場合にフォローアップの検査を行う。
・小児患者では、グレード2の眼障害が発生した場合、減量を検討する必要がある。また、グレード3又は4の眼障害では、他の原因が特定されない限り永久に中止する必
要がある。
措置区分※4
本邦における
措置内容※5
情報提供
注目
情報提供
対応不要
テガフール・ギメラシル・オテ
186 ラシルカリウム配合剤
カペシタビン
仏ANSMは、5-FU及びカペシタビン化学療法のジヒドロピリミジンデヒドロゲナーゼ(DPD)欠損患者への投与禁忌をリマインドする医療関係者向けのレターを発出した。
フランス
情報提供
注目
耐性乳酸菌配合剤
193 ビフィズス菌配合剤
ラクトミン
FDAより、院内におけるプロバイオティクスの早産児への使用について、以下の内容の医療提供者向けレターが発行された。
・プロバイオティクスを投与された早産児は、プロバイオティクスに含まれる細菌または真菌によって引き起こされる、侵襲性かつ致命的な疾患のリスクがある。
・症例は出生時体重1000g未満の早産児で、入院加療中に生菌Bifidobacterium longum subsp. infantisを含有するプロバイオティクスを投与され、Bifidobacterium longum
による敗血症を発症して死亡した。
アメリカ
・FDAはこの早産児の死亡について調査しており、敗血症を引き起こした細菌は、このプロバイオティクスに含まれる細菌と遺伝子的に一致していたことが、ゲノム配列決
定データから証明されている。
・プロバイオティクス製品を医薬品または生物学的製剤として乳児に使用することを承認していない。
情報提供
注目
196 スクラルファート水和物
米国.のスクラルファート経口懸濁液1g/10mLにBacillus cereusの混入が確認されたことから1ロットを自主回収した。
回収
対応不要
199 ガドジアミド水和物
ガドジアミド水和物の米国添付文書改訂が改訂され、Boxed warning、Warnings and Precautions及びPost marketing experience等へ髄腔内投与のリスクについて追記さ
アメリカ
れた。
添付文書改
訂(警告・禁
忌)
対応済
200 デュロキセチン塩酸塩
ドイツLocal Authorityはデュロキセチンに暫定許容一日摂取量を超えるニトロソアミン不純物が含まれていることが判明したため一部の製品で回収を行う予定であるとの情
ドイツ
報を海外提携会社より入手した。
回収
注目
210 シクロスポリン
【第1報】
米国でシクロスポリン100 MG/ML内用液の製剤容器内の溶液中に結晶が認められたため、対象1ロットの回収を行った。
【第2報】
米国でシクロスポリン100 MG/ML内用液の製剤容器内の溶液中に結晶が認められたため、米国でさらに対象2ロットの回収を行った。
アメリカ、
スイス
回収
対応不要
香港
情報提供
対応済
シタグリプチンリン酸塩水和物
シタグリプチンリン酸塩水和
225 物・イプラグリフロジン L-プ 香港保健当局は、DPP-4阻害薬使用後の水疱性類天疱瘡のリスクについて、医療従事者向けの注意喚起文書を公表した。
ロリン配合剤
オマリグリプチン
アメリカ
229 トリアムシノロンアセトニド
米国FDAは、トリアムシノロンアセトニド製剤について、バイアルに粒子状物質の存在(ガラス片確認のクレーム)の理由よりクラスⅡの自主回収を実施していると公表した。 アメリカ
回収
対応不要
238 アシミニブ塩酸塩
ラットを用いた2年間がん原性試験の結果、雌の卵巣でセルトリ細胞に関する所見が認められたため、Aggregate Finding Safety Report(AFSR)が発出された。
スイス
情報提供
注目
239 ケタミン塩酸塩
Esketamineの米国添付文書が改訂された。
・Warnings and precautionsの項に、市販後に呼吸抑制の報告があった、治療毎に呼吸状態の変化を少なくとも2時間監視しなければならない旨が追記。
・Box Warning、Adverse reactionsの項に呼吸抑制が追記。
アメリカ
添付文書改
訂(警告・禁
忌)
対応済
246 メチルフェニデート塩酸塩
米国添付文書が改訂された。主な内容は以下のとおり。
・Boxed Warning、Warnings and Precautionsの項に、誤用、乱用の可能性が高く、物質使用障害の発症、過剰摂取や死亡につながる可能性がある。このリスクは高用量や
経鼻、注射等の未承認の投与方法で増加する。旨、処方前に各患者の乱用、誤用、中毒のリスクを評価すること。本剤のリスクや適切な保管、未使用薬剤の適切な廃棄 アメリカ
について、患者及びその家族を教育すること。投与期間中、各患者の乱用、誤用、嗜癖のリスクを再評価し、徴候及び症状を頻繁にモニタリングすること。 旨を追記。
・Warnings and Precautionsの項に、運動性チック、言語性チック、トゥレット症候群の悪化、急性閉塞隅角緑内障、眼圧上昇、緑内障が追記。
添付文書改
訂(警告・禁
忌)
対応中
5
24