よむ、つかう、まなぶ。
【資料4】医薬局からの定期報告[2.0MB] (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
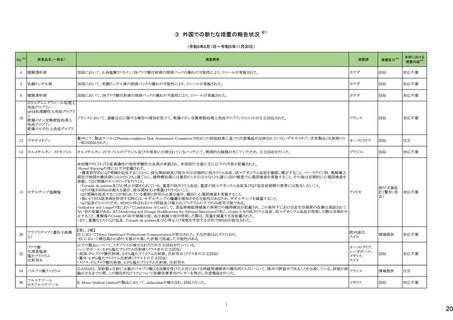
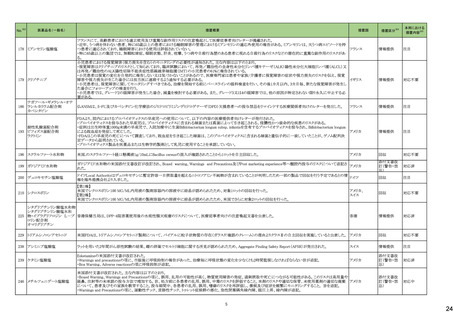
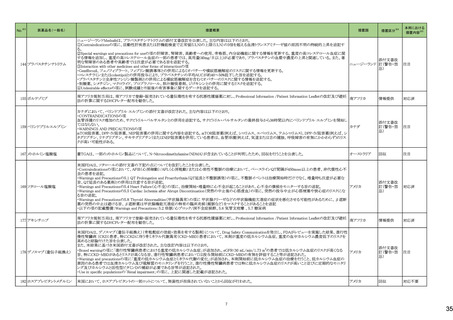
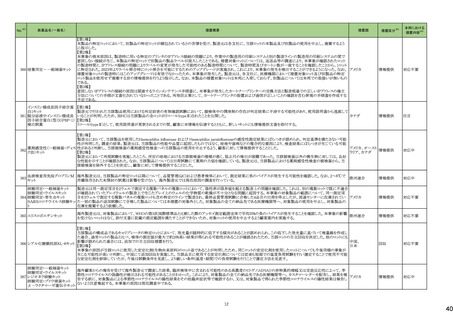
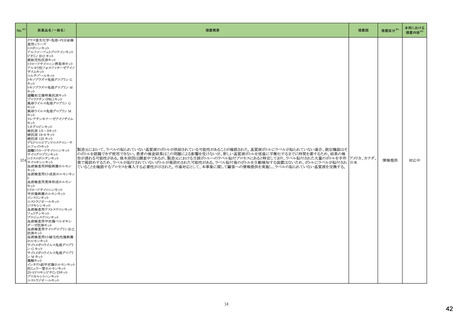
3 外国での新たな措置の報告状況 ※1
(令和5年8月1日~令和5年11月30日)
No.※2
医薬品名(一般名)
措置概要
措置国
措置区分※4
本邦における
措置内容※5
4
腹膜透析液
加国において、0.4%塩酸リドカイン/5%ブドウ糖注射液の溶液バックの漏れの可能性により、リコールが実施された。
カナダ
回収
対応不要
5
乳酸リンゲル液
加国において、乳酸リンゲル液の溶液バックの漏れの可能性により、リコールが実施された。
カナダ
回収
対応不要
6
腹膜透析液
加国において、5%ブドウ糖注射液の溶液バックの漏れの可能性により、リコールが実施された。
カナダ
回収
対応不要
フランス
回収
対応不要
オーストラリア
回収
注目
ブラジル
回収
対応不要
10
13
14
ポリエチレングリコール処理人
免疫グロブリン
pH4処理酸性人免疫グロブリ
ン
フランスにおいて、過敏反応に関する報告の増加を受けて、乾燥イオン交換樹脂処理人免疫グロブリンの1ロットが自主回収された。
乾燥イオン交換樹脂処理人
免疫グロブリン
乾燥スルホ化人免疫グロブリ
ン
豪州にて、製品ラベルにPharmacovigilance Risk Assessment Committee(PRAC)の評価結果に基づく注意喚起が反映されていないデキサメタゾン含有製品(注射剤)の
デキサメタゾン
一部が回収された。
オルメサルタン メドキソミル
オルメサルタン メドキソミルのブラジル及び中南米に出荷されているバッチにて、物理的な破損が生じていたため、自主回収を行った。
15
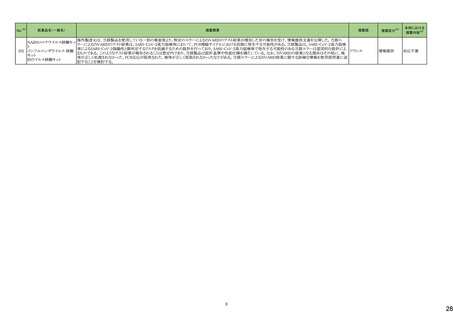
キザルチニブ塩酸塩
未治療のFLT3-ITD変異陽性の急性骨髄性白血病が承認され、米国添付文書に主に以下の内容が記載された。
・Boxed Warningの項に以下が記載された。
・濃度依存的にQT間隔を延長することから、投与開始前及び投与中は定期的に低カリウム血症、低マグネシウム血症を確認し補正すること。ベースライン時、寛解導入
期及び地固め療法期には少なくとも1週ごとに、維持療法期には最初の1カ月は少なくとも週に1回の頻度で心電図検査を実施すること。その後は定期的に心電図検査を
実施してQT間隔のモニタリングを行うこと。
・Torsade de pointes及び心停止が認められている。重度の低カリウム血症、重度の低マグネシウム血症及びQT延長症候群の患者には投与しないこと。
・QTcF値が450msを超える場合、投与開始又は増量は行わないこと。
アメリカ
・QT間隔を延長することが知られている薬剤と併用が必要な場合、頻回に心電図検査を実施すること。
・強いCYP3A阻害剤を併用する時には、キザルチニブの曝露を増加させる可能性があるため、ギザルチニブを減量すること。
・QT延長のリスクのため、REMSと呼ばれるリスク評価及び最小化プログラムの下でのみ使用可能である。
・Indication and Usageの項においてLimitations of Useとして、造血幹細胞移植後の単剤での維持療法が記載され、この条件下における全生存期間の改善は実証されて
ない旨の記載がある。またMonitoring and Dosage Modifications for Adverse Reactionsの項に、Grade 3/4の低カリウム血症、低マグネシウム血症が発現した際は本剤を中
止すること、寛解後のGrade 4の好中球減少症、血小板減少症が発現した際は、用量を減量する旨記載された。
・また、重篤なリスク(QT延長、Torsade de pointes及び心停止)の発現を予防する目的でREMSが設定された。
添付文書改
訂(警告・禁
忌)
対応不要
30
アテゾリズマブ(遺伝子組換
え)
【第1、2報】
EUにおいてDirect Healthcare Professional Communicationが発出された。主な内容は以下のとおり。
・EUにおいて梱包箱から添付文書が欠落した状態で流通した可能性がある。
欧州連合、
スイス
情報提供
対応不要
32
ブドウ糖
生理食塩液
塩化ナトリウム
注射用水
以下の製品について、ミダゾラムが検出されたため自主回収を行っている。
・シンガポール:0.9%塩化ナトリウム注射液(クラスⅡの自主回収)
・英国:5%ブドウ糖注射液、0.9%塩化ナトリウム注射液、注射用水(クラスⅡの自主回収)
・豪州:0.9%塩化ナトリウム注射液(クラスⅠの自主回収)
・スイス:5%ブドウ糖注射液、0.9%塩化ナトリウム注射液、注射用水
オーストラリア、
シンガポール、
イギリス、
スイス
回収
対応不要
34
バルプロ酸ナトリウム
仏ANSMは、受胎数ヵ月前に父親がバルプロ酸よる治療を受けた小児における神経発達障害の潜在的リスクについて、欧州で評価中であることを公表している。評価の結
フランス
論が出るまでの間、この潜在的なリスクについて医療従事者向けレターを発出し注意喚起を行った。
情報提供
注目
38
フルコナゾール
ホスフルコナゾール
B. Braun Medical Limitedの製品において、midazolamが検出され、回収となった。
回収
対応不要
イギリス
1
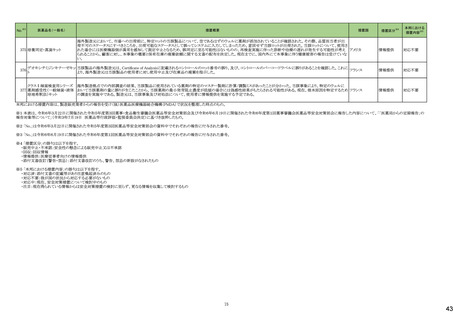
20
(令和5年8月1日~令和5年11月30日)
No.※2
医薬品名(一般名)
措置概要
措置国
措置区分※4
本邦における
措置内容※5
4
腹膜透析液
加国において、0.4%塩酸リドカイン/5%ブドウ糖注射液の溶液バックの漏れの可能性により、リコールが実施された。
カナダ
回収
対応不要
5
乳酸リンゲル液
加国において、乳酸リンゲル液の溶液バックの漏れの可能性により、リコールが実施された。
カナダ
回収
対応不要
6
腹膜透析液
加国において、5%ブドウ糖注射液の溶液バックの漏れの可能性により、リコールが実施された。
カナダ
回収
対応不要
フランス
回収
対応不要
オーストラリア
回収
注目
ブラジル
回収
対応不要
10
13
14
ポリエチレングリコール処理人
免疫グロブリン
pH4処理酸性人免疫グロブリ
ン
フランスにおいて、過敏反応に関する報告の増加を受けて、乾燥イオン交換樹脂処理人免疫グロブリンの1ロットが自主回収された。
乾燥イオン交換樹脂処理人
免疫グロブリン
乾燥スルホ化人免疫グロブリ
ン
豪州にて、製品ラベルにPharmacovigilance Risk Assessment Committee(PRAC)の評価結果に基づく注意喚起が反映されていないデキサメタゾン含有製品(注射剤)の
デキサメタゾン
一部が回収された。
オルメサルタン メドキソミル
オルメサルタン メドキソミルのブラジル及び中南米に出荷されているバッチにて、物理的な破損が生じていたため、自主回収を行った。
15
キザルチニブ塩酸塩
未治療のFLT3-ITD変異陽性の急性骨髄性白血病が承認され、米国添付文書に主に以下の内容が記載された。
・Boxed Warningの項に以下が記載された。
・濃度依存的にQT間隔を延長することから、投与開始前及び投与中は定期的に低カリウム血症、低マグネシウム血症を確認し補正すること。ベースライン時、寛解導入
期及び地固め療法期には少なくとも1週ごとに、維持療法期には最初の1カ月は少なくとも週に1回の頻度で心電図検査を実施すること。その後は定期的に心電図検査を
実施してQT間隔のモニタリングを行うこと。
・Torsade de pointes及び心停止が認められている。重度の低カリウム血症、重度の低マグネシウム血症及びQT延長症候群の患者には投与しないこと。
・QTcF値が450msを超える場合、投与開始又は増量は行わないこと。
アメリカ
・QT間隔を延長することが知られている薬剤と併用が必要な場合、頻回に心電図検査を実施すること。
・強いCYP3A阻害剤を併用する時には、キザルチニブの曝露を増加させる可能性があるため、ギザルチニブを減量すること。
・QT延長のリスクのため、REMSと呼ばれるリスク評価及び最小化プログラムの下でのみ使用可能である。
・Indication and Usageの項においてLimitations of Useとして、造血幹細胞移植後の単剤での維持療法が記載され、この条件下における全生存期間の改善は実証されて
ない旨の記載がある。またMonitoring and Dosage Modifications for Adverse Reactionsの項に、Grade 3/4の低カリウム血症、低マグネシウム血症が発現した際は本剤を中
止すること、寛解後のGrade 4の好中球減少症、血小板減少症が発現した際は、用量を減量する旨記載された。
・また、重篤なリスク(QT延長、Torsade de pointes及び心停止)の発現を予防する目的でREMSが設定された。
添付文書改
訂(警告・禁
忌)
対応不要
30
アテゾリズマブ(遺伝子組換
え)
【第1、2報】
EUにおいてDirect Healthcare Professional Communicationが発出された。主な内容は以下のとおり。
・EUにおいて梱包箱から添付文書が欠落した状態で流通した可能性がある。
欧州連合、
スイス
情報提供
対応不要
32
ブドウ糖
生理食塩液
塩化ナトリウム
注射用水
以下の製品について、ミダゾラムが検出されたため自主回収を行っている。
・シンガポール:0.9%塩化ナトリウム注射液(クラスⅡの自主回収)
・英国:5%ブドウ糖注射液、0.9%塩化ナトリウム注射液、注射用水(クラスⅡの自主回収)
・豪州:0.9%塩化ナトリウム注射液(クラスⅠの自主回収)
・スイス:5%ブドウ糖注射液、0.9%塩化ナトリウム注射液、注射用水
オーストラリア、
シンガポール、
イギリス、
スイス
回収
対応不要
34
バルプロ酸ナトリウム
仏ANSMは、受胎数ヵ月前に父親がバルプロ酸よる治療を受けた小児における神経発達障害の潜在的リスクについて、欧州で評価中であることを公表している。評価の結
フランス
論が出るまでの間、この潜在的なリスクについて医療従事者向けレターを発出し注意喚起を行った。
情報提供
注目
38
フルコナゾール
ホスフルコナゾール
B. Braun Medical Limitedの製品において、midazolamが検出され、回収となった。
回収
対応不要
イギリス
1
20