よむ、つかう、まなぶ。
【資料4】医薬局からの定期報告[2.0MB] (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
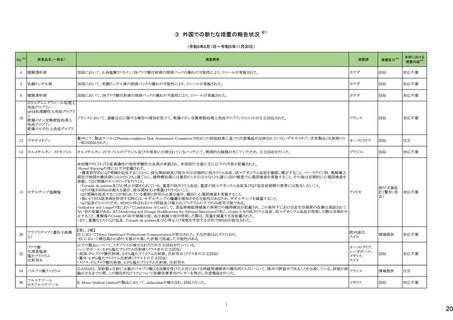
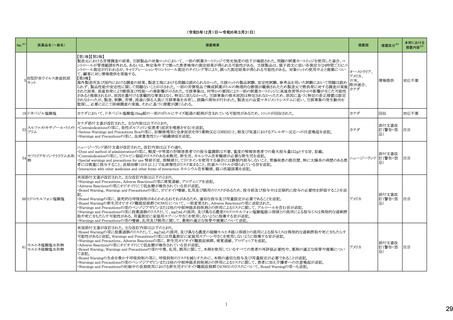
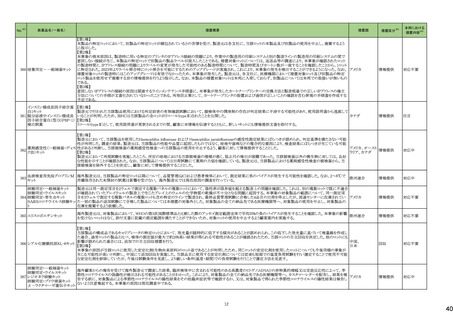
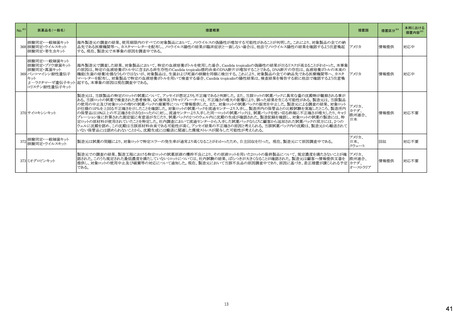
No.※2
医薬品名(一般名)
114
トロピカミド・フェニレフリン塩
酸塩
措置概要
措置国
対応不要
117 レンバチニブメシル酸塩
レンバチニブとペムブロリズマブの併用療法(以下、「本併用療法」)をPD-L1陽性の再発又は転移性頭頸部扁平上皮癌の一次治療として評価する臨床第Ⅲ相試験
(LEAP-010試験(以下、「本試験」))の状況について、プレスリリース及び治験責任医師へのレターが発行された。主な内容は以下のとおり。
・本試験の主要評価項目は、全生存期間(Overall Survival: OS)、盲検化された中央画像判定機関が評価した無増悪生存期間及び奏効率である。2回目の中間解析に
おいて、本併用療法は、ペムブロリズマブ単剤療法に対しOSの改善を示さず、治験実施計画書で規定されたOSの統計学的有意性の閾値に達する可能性は低いと判断
されたことから、本試験でのレンバチニブ/プラセボの投与を中止することについて治験責任医師への伝達を開始した。本併用療法の安全性プロファイルは、これまでに アメリカ
報告されているデータと同様であった。
・今回の解析結果及びレンバチニブ/プラセボ投与中止の決定に基づき、本試験は盲検解除される予定である。治験依頼者は、全被験者がレンバチニブ/プラセボの
服用を中止することを勧告するが、症例ごとの状況に応じて、レンバチニブの継続や投与第2期への移行について治験依頼者との協議が可能である。なお、ペムブロリズ
マブの投与は治験実施計画書の規定通り継続する。
情報提供
対応不要
126 ジゴキシン
米国FDAはDigoxin錠 USP 0.25mgの複数のボトルにDigoxin錠 USP 0.125mgの不正確なラベルが貼られており、Digoxin錠 USP 0.125mgの複数のボトルにDigoxin錠 USP
0.25mgの不正確なラベルが貼られた製品が流通され、このラベルの混同により、知らずに誤った用量を服用した患者に過量投与または過少投与を引き起こす可能性があ アメリカ
るため自主回収となっていることを公表した。
回収
対応不要
モキシフロキサシン塩酸塩
148 レボフロキサシン水和物
シタフロキサシン水和物
ニュージーランドMedsafeがフルオロキノロン系抗菌剤による腱炎及び神経障害についての注意喚起を実施し、承認された効能又は効果においてのみ使用されるべきで
あり、個々の患者にとってのベネフィットとリスクを十分に評価した上で使用する必要がある旨、情報提供した。
ニュージーランド 情報提供
対応不要
150 ゲムシタビン塩酸塩
誤ったラベル(2000mg/200mlではなく1800mg/180mlと表示される)が貼られていることにより、特定バッチの製品が回収されている。
イギリス
回収
対応不要
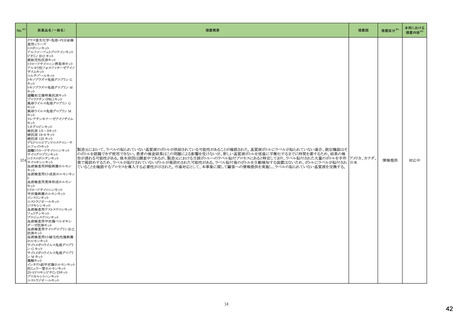
添付文書改
訂(警告・禁
忌)
対応中
情報提供
対応不要
166 オラパリブ
アメリカ
本邦における
措置内容※5
回収
164 テモゾロミド
米国FDAは、無菌性保証欠如のためフェニレフリン/塩化ナトリウム含有バッグ、シリンジ製剤について、クラスⅡの自主回収を実施していると公表した。
措置区分※4
米国FDAは、特定の古い腫瘍用薬の添付文書情報を更新する、Oncology Center of Excellence(OCE)のProject Renewalに基づき、添付文書の改訂を承認した。主な改
訂内容は以下のとおり。
・Contraindicationの項に、テモゾロミド又はダカルバジンにより重篤な過敏症反応の病歴のある患者が記載された。
・Warnings and Precautionsの項に、骨髄抑制が生じることから、血球のモニタリングを行うこと、また重度の骨髄抑制の場合は投与を中止し、発現状況に応じて同用量又
は減量して再開することが記載された。
・Warnings and Precautionsの項に、肝毒性があること及び肝機能検査を実施することが記載された。
・Warnings and Precautionsの項に、二次性悪性腫瘍が記載された。
アメリカ
・Warnings and Precautionsの項に、妊娠中の女性や生殖能力のある女性には、胎児に対する潜在的なリスクについて助言すること、生殖能力のある女性には、治療中及
び最終投与後6カ月間は効果的な避妊法を使用するよう助言すること、生殖能力のある男性患者には、治療中及び最終投与後3カ月間はコンドームを使用するよう助言
すること及び男性患者には治療中及び最終投与後3カ月間は精液を提供しないよう助言することが記載された。
・Warnings and Precautionsの項に、カプセルを開封したり、噛んだり、内容物を溶かさないこと、カプセル全体をコップ1杯の水と一緒に飲み込むこと、カプセルが破損した
場合は、内容物の粉末が皮膚や粘膜に触れないよう注意し、粉末に触れた場合は、直ちに患部を水で洗うこと及び内容物を溶解する必要がある場合は、危険薬物の安
全な取り扱いについて訓練を受けた専門家が、適切な機器と安全手順を使用して行う必要があることが記載された。
【第1報、第2報】
白金系抗悪性腫瘍剤を含む化学療法に対して完全奏効又は部分奏効を示している患者を対象とした2つのランダム化プラセボ対照試験(19試験及びSOLO2試験)の結
果、BRCA変異陰性患者の全生存期間データに基づき、米国FDAは、リムパーザを含むすべてのPARP阻害薬は、再発卵巣癌の維持療法としての使用をBRCA変異を有
する患者に限定すべきと結論付けた。 また本件に関するDear Healthcare Provider Letterが発出された。なお、いずれの試験でも主要評価項目である無増悪生存期間 アメリカ
(PFS)を達成した。
試験19及びSOLO2試験で新たな安全性所見は報告されておらず、これらの試験の安全性データはリムパーザを用いた他の臨床試験で報告された安全性データと一致し
ている。
エゼチミブ
エゼチミブ・アトルバスタチン
168 カルシウム水和物配合剤
エゼチミブ・ロスバスタチンカ
ルシウム配合剤
米国FDAは、bempedoic acid/エゼチミブの対象ロットの溶出仕様が不適合のため、回収情報を公表した。
アメリカ
回収
対応不要
171 生理食塩液
米国において、生理食塩液製剤の無菌試験で不適格であったロットがあったことから、回収が実施された。
アメリカ
回収
対応不要
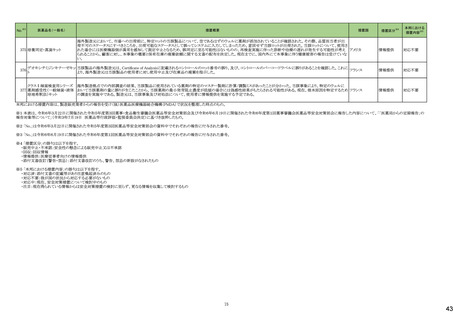
177 リュープロレリン酢酸塩
【第1報】
安定性試験において原薬の測定で規格外の結果が得られたとして回収となった。
【第2報】
オーストラリア
回収対象のロットにおける追加試験の結果、予定量の倍量の原薬が含まれていたことから、安定性試験にて規格外となった原因はシリンジに倍量の原薬が充填されてい
たためと考えられる。
回収
対応不要
4
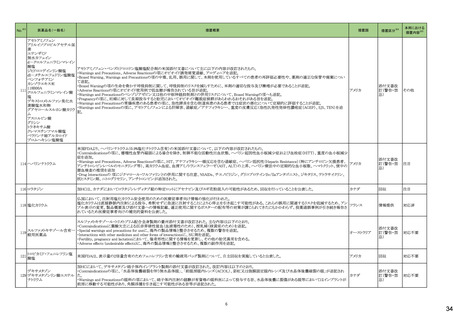
23
医薬品名(一般名)
114
トロピカミド・フェニレフリン塩
酸塩
措置概要
措置国
対応不要
117 レンバチニブメシル酸塩
レンバチニブとペムブロリズマブの併用療法(以下、「本併用療法」)をPD-L1陽性の再発又は転移性頭頸部扁平上皮癌の一次治療として評価する臨床第Ⅲ相試験
(LEAP-010試験(以下、「本試験」))の状況について、プレスリリース及び治験責任医師へのレターが発行された。主な内容は以下のとおり。
・本試験の主要評価項目は、全生存期間(Overall Survival: OS)、盲検化された中央画像判定機関が評価した無増悪生存期間及び奏効率である。2回目の中間解析に
おいて、本併用療法は、ペムブロリズマブ単剤療法に対しOSの改善を示さず、治験実施計画書で規定されたOSの統計学的有意性の閾値に達する可能性は低いと判断
されたことから、本試験でのレンバチニブ/プラセボの投与を中止することについて治験責任医師への伝達を開始した。本併用療法の安全性プロファイルは、これまでに アメリカ
報告されているデータと同様であった。
・今回の解析結果及びレンバチニブ/プラセボ投与中止の決定に基づき、本試験は盲検解除される予定である。治験依頼者は、全被験者がレンバチニブ/プラセボの
服用を中止することを勧告するが、症例ごとの状況に応じて、レンバチニブの継続や投与第2期への移行について治験依頼者との協議が可能である。なお、ペムブロリズ
マブの投与は治験実施計画書の規定通り継続する。
情報提供
対応不要
126 ジゴキシン
米国FDAはDigoxin錠 USP 0.25mgの複数のボトルにDigoxin錠 USP 0.125mgの不正確なラベルが貼られており、Digoxin錠 USP 0.125mgの複数のボトルにDigoxin錠 USP
0.25mgの不正確なラベルが貼られた製品が流通され、このラベルの混同により、知らずに誤った用量を服用した患者に過量投与または過少投与を引き起こす可能性があ アメリカ
るため自主回収となっていることを公表した。
回収
対応不要
モキシフロキサシン塩酸塩
148 レボフロキサシン水和物
シタフロキサシン水和物
ニュージーランドMedsafeがフルオロキノロン系抗菌剤による腱炎及び神経障害についての注意喚起を実施し、承認された効能又は効果においてのみ使用されるべきで
あり、個々の患者にとってのベネフィットとリスクを十分に評価した上で使用する必要がある旨、情報提供した。
ニュージーランド 情報提供
対応不要
150 ゲムシタビン塩酸塩
誤ったラベル(2000mg/200mlではなく1800mg/180mlと表示される)が貼られていることにより、特定バッチの製品が回収されている。
イギリス
回収
対応不要
添付文書改
訂(警告・禁
忌)
対応中
情報提供
対応不要
166 オラパリブ
アメリカ
本邦における
措置内容※5
回収
164 テモゾロミド
米国FDAは、無菌性保証欠如のためフェニレフリン/塩化ナトリウム含有バッグ、シリンジ製剤について、クラスⅡの自主回収を実施していると公表した。
措置区分※4
米国FDAは、特定の古い腫瘍用薬の添付文書情報を更新する、Oncology Center of Excellence(OCE)のProject Renewalに基づき、添付文書の改訂を承認した。主な改
訂内容は以下のとおり。
・Contraindicationの項に、テモゾロミド又はダカルバジンにより重篤な過敏症反応の病歴のある患者が記載された。
・Warnings and Precautionsの項に、骨髄抑制が生じることから、血球のモニタリングを行うこと、また重度の骨髄抑制の場合は投与を中止し、発現状況に応じて同用量又
は減量して再開することが記載された。
・Warnings and Precautionsの項に、肝毒性があること及び肝機能検査を実施することが記載された。
・Warnings and Precautionsの項に、二次性悪性腫瘍が記載された。
アメリカ
・Warnings and Precautionsの項に、妊娠中の女性や生殖能力のある女性には、胎児に対する潜在的なリスクについて助言すること、生殖能力のある女性には、治療中及
び最終投与後6カ月間は効果的な避妊法を使用するよう助言すること、生殖能力のある男性患者には、治療中及び最終投与後3カ月間はコンドームを使用するよう助言
すること及び男性患者には治療中及び最終投与後3カ月間は精液を提供しないよう助言することが記載された。
・Warnings and Precautionsの項に、カプセルを開封したり、噛んだり、内容物を溶かさないこと、カプセル全体をコップ1杯の水と一緒に飲み込むこと、カプセルが破損した
場合は、内容物の粉末が皮膚や粘膜に触れないよう注意し、粉末に触れた場合は、直ちに患部を水で洗うこと及び内容物を溶解する必要がある場合は、危険薬物の安
全な取り扱いについて訓練を受けた専門家が、適切な機器と安全手順を使用して行う必要があることが記載された。
【第1報、第2報】
白金系抗悪性腫瘍剤を含む化学療法に対して完全奏効又は部分奏効を示している患者を対象とした2つのランダム化プラセボ対照試験(19試験及びSOLO2試験)の結
果、BRCA変異陰性患者の全生存期間データに基づき、米国FDAは、リムパーザを含むすべてのPARP阻害薬は、再発卵巣癌の維持療法としての使用をBRCA変異を有
する患者に限定すべきと結論付けた。 また本件に関するDear Healthcare Provider Letterが発出された。なお、いずれの試験でも主要評価項目である無増悪生存期間 アメリカ
(PFS)を達成した。
試験19及びSOLO2試験で新たな安全性所見は報告されておらず、これらの試験の安全性データはリムパーザを用いた他の臨床試験で報告された安全性データと一致し
ている。
エゼチミブ
エゼチミブ・アトルバスタチン
168 カルシウム水和物配合剤
エゼチミブ・ロスバスタチンカ
ルシウム配合剤
米国FDAは、bempedoic acid/エゼチミブの対象ロットの溶出仕様が不適合のため、回収情報を公表した。
アメリカ
回収
対応不要
171 生理食塩液
米国において、生理食塩液製剤の無菌試験で不適格であったロットがあったことから、回収が実施された。
アメリカ
回収
対応不要
177 リュープロレリン酢酸塩
【第1報】
安定性試験において原薬の測定で規格外の結果が得られたとして回収となった。
【第2報】
オーストラリア
回収対象のロットにおける追加試験の結果、予定量の倍量の原薬が含まれていたことから、安定性試験にて規格外となった原因はシリンジに倍量の原薬が充填されてい
たためと考えられる。
回収
対応不要
4
23