よむ、つかう、まなぶ。
【資料4】医薬局からの定期報告[2.0MB] (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
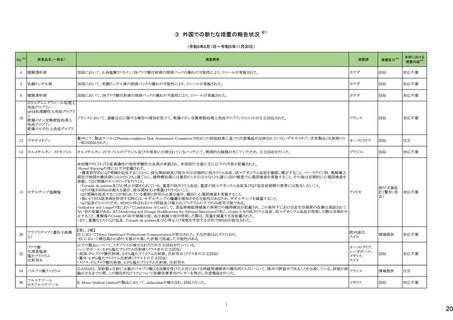
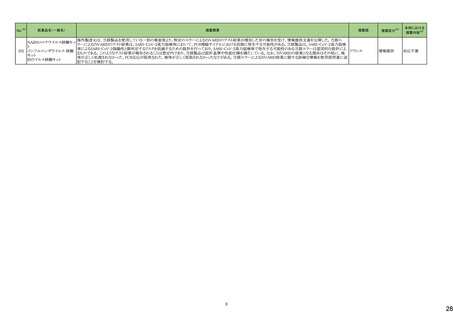
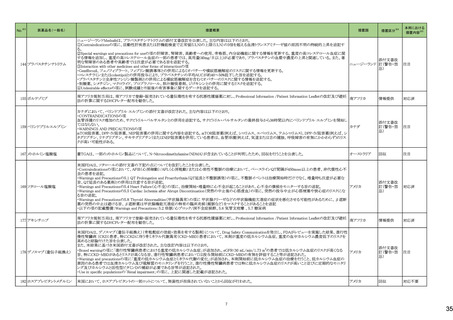
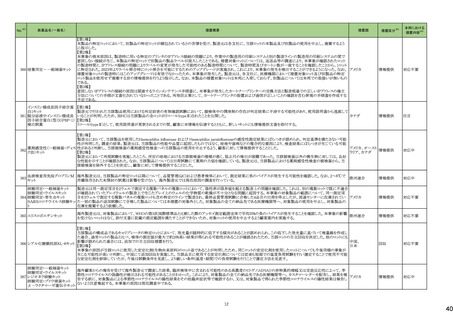
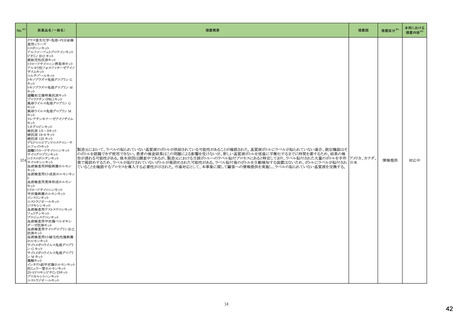
No.※2
医薬品名(一般名)
措置概要
措置国
炭酸水素ナトリウム
生理食塩液
252 塩化ナトリウム
米国において炭酸水素ナトリウム注射液、ミダゾラム(塩化ナトリウム含有)注射液、システイン塩酸塩注射液が回収された。
高カロリー輸液用総合アミノ酸
製剤
アメリカ
措置区分※4
本邦における
措置内容※5
回収
対応不要
添付文書改
訂(警告・禁
忌)
対応済
253
リスデキサンフェタミンメシル
酸塩
米国添付文書が改訂された。主な内容は以下のとおり。
・Boxed Warning、Warnings and Precautionsの項に、誤用、乱用の可能性が高く、物質使用障害の発症、過剰摂取や死亡につながる可能性がある。このリスクは高用量や
経鼻、注射等の未承認の投与方法で増加する。処方前に各患者の乱用、誤用、中毒のリスクを評価すること。本剤のリスクや適切な保管、未使用薬剤の適切な廃棄につ アメリカ
いて、患者及びその家族を教育すること。投与期間中、各患者の乱用、誤用、嗜癖のリスクを再評価し、徴候及び症状を頻繁にモニタリングすること。が追記。
・Warnings and Precautionsの項に、運動性チック、言語性チック、トゥレット症候群の悪化が追記。
257
ペルツズマブ(遺伝子組換
え)
ジャマイカで配布された添付文書に誤った適応症(HER2陽性乳癌の術後薬物療法)が含まれていた旨が医療関係者に通知された。
スイス
情報提供
対応不要
258
トロピカミド・フェニレフリン塩
酸塩
米国FDAは、無菌性保証欠如のためフェニレフリン/塩化ナトリウム含有バイアル製剤、点眼薬について、クラスⅡの自主回収を実施していると公表した。
アメリカ
回収
対応不要
260
ベバシズマブ(遺伝子組換
え)
特定ロットのベバシズマブ製品について回収が行われている。
アメリカ
回収
対応不要
267 ダサチニブ水和物
特定のバッチの製剤について回収を行っている。
オーストラリア
回収
対応不要
269 イトラコナゾール
米国添付文書が改訂され、Contraindicationsに併用禁忌としてフィネレノン、 voclosporin、Warnings and Precautionsの項に併用注意として、mobocertinib、エヌトレクチニ
アメリカ
ブ、ペミガチニブが追加された。
添付文書改
訂(警告・禁
忌)
対応済
273 ブロスマブ(遺伝子組換え)
イスラエルにて、無菌性の問題により、ブロスマブ製剤が回収された。
イスラエル
回収
対応不要
276 アロプリノール
スイスにて、アロプリノール錠の一部のバッチが、スルファメトキサゾール・トリメトプリムが混入した可能性があることから回収された。
スイス
回収
対応不要
279 ピタバスタチンカルシウム
ピタバスタチンの米国添付文書が改訂された。主な内容は以下のとおり。
<Contraindicationsの項>
①急性肝不全あるいは非代償性肝硬変を追記する。
②ピタバスタチンあるいは本剤の賦形剤に対する過敏症を追記する。
<Warnings and Precautionsの項>
③ミオパチーと横紋筋融解症の項に、ミオグロビン尿に続発する急性腎障害が横紋筋融解症の結果として発生する旨、ミオパチーのリスク因子として、特定の薬物の併用
(他の脂質低下療法を含む)、本剤の高用量投与を追記する。
④免疫介在性壊死性ミオパチーの項に、自己免疫性ミオパチーである免疫介在性壊死性ミオパチーは、スタチン使用に関連し、同じまたは異なるスタチンが投与された
場合の再発の報告を含む、まれな報告がある旨、免疫介在性壊死性ミオパシーが疑われた場合は、本剤を中止することを追記する。
⑤肝機能障害の項に、本剤で血清トランスアミナーゼの上昇が報告されている。ほとんどの症例で、これらの変化は開始直後に現れ、一過性であり、症状を伴わず、治療
の継続または治療の短期中断後に消失または改善した旨、本剤は急性肝不全または非代償性肝硬変患者において禁忌である旨を追記する。
<Adverse Reactionsの項>
アメリカ
⑥Clinical Trial Experienceの項のTable.1を記載整備する。
⑦Postmarketing Experienceの項に、眼筋無力症を含む重症筋無力症の新規発症または増悪がまれに報告されており、同じスタチンまたは異なるスタチンを投与した場合
に再発が報告されている旨、扁平苔癬を追記する。
<Use in Specific Populationの項>
⑧Pregnancy、Lactationの項をPLLRに従い変更する。Lactationの項のRisk Summaryに、ヒトまたは動物の乳汁中の本剤の存在、授乳中の乳児に対する本剤の影響、また
は乳汁産生に対する本剤の影響に関する入手可能な情報はない。本剤を含むスタチンは、コレステロール合成、おそらくコレステロール由来の他の生物学的活性物質の
合成を低下させ、授乳中の乳児に害を及ぼす可能性がある。母乳栄養児では重篤な副作用の可能性があるため、作用機序に基づき、本剤による治療中は母乳育児が
推奨されないことを患者に助言することを追記する。
⑨高齢者の項に、高齢者ではミオパチーのリスク増加のため、モニターすることを追記する。
⑩腎障害の項に、腎機能障害のある全ての患者について、ミオパシーの発現をモニタリングすることを追記する。
⑪肝障害の項に、本剤は急性肝不全あるいは非代償性肝硬変患者では禁忌である旨を追記する。
添付文書改
訂(警告・禁
忌)
対応中
回収
対応不要
【第1報】
ドイツにおいて、エボロクマブのオートミニドーザーが注入不能のため、不具合の対象ロットについて回収された。
281 エボロクマブ(遺伝子組換え)
【第2報】
ドイツに流通する使用期限前の全ロットを予防措置として回収することとした。
6
ドイツ
25
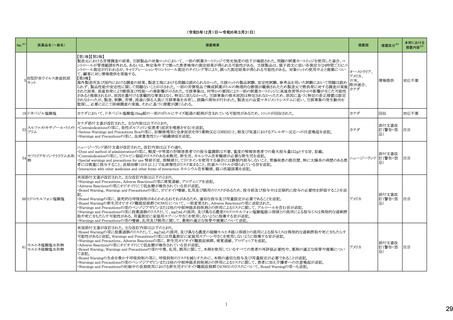
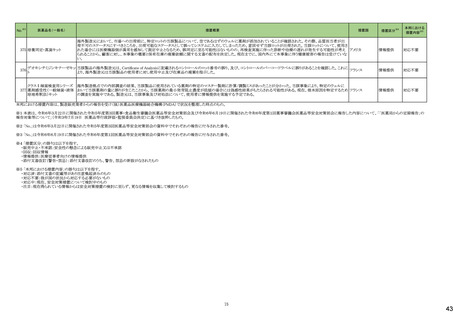
医薬品名(一般名)
措置概要
措置国
炭酸水素ナトリウム
生理食塩液
252 塩化ナトリウム
米国において炭酸水素ナトリウム注射液、ミダゾラム(塩化ナトリウム含有)注射液、システイン塩酸塩注射液が回収された。
高カロリー輸液用総合アミノ酸
製剤
アメリカ
措置区分※4
本邦における
措置内容※5
回収
対応不要
添付文書改
訂(警告・禁
忌)
対応済
253
リスデキサンフェタミンメシル
酸塩
米国添付文書が改訂された。主な内容は以下のとおり。
・Boxed Warning、Warnings and Precautionsの項に、誤用、乱用の可能性が高く、物質使用障害の発症、過剰摂取や死亡につながる可能性がある。このリスクは高用量や
経鼻、注射等の未承認の投与方法で増加する。処方前に各患者の乱用、誤用、中毒のリスクを評価すること。本剤のリスクや適切な保管、未使用薬剤の適切な廃棄につ アメリカ
いて、患者及びその家族を教育すること。投与期間中、各患者の乱用、誤用、嗜癖のリスクを再評価し、徴候及び症状を頻繁にモニタリングすること。が追記。
・Warnings and Precautionsの項に、運動性チック、言語性チック、トゥレット症候群の悪化が追記。
257
ペルツズマブ(遺伝子組換
え)
ジャマイカで配布された添付文書に誤った適応症(HER2陽性乳癌の術後薬物療法)が含まれていた旨が医療関係者に通知された。
スイス
情報提供
対応不要
258
トロピカミド・フェニレフリン塩
酸塩
米国FDAは、無菌性保証欠如のためフェニレフリン/塩化ナトリウム含有バイアル製剤、点眼薬について、クラスⅡの自主回収を実施していると公表した。
アメリカ
回収
対応不要
260
ベバシズマブ(遺伝子組換
え)
特定ロットのベバシズマブ製品について回収が行われている。
アメリカ
回収
対応不要
267 ダサチニブ水和物
特定のバッチの製剤について回収を行っている。
オーストラリア
回収
対応不要
269 イトラコナゾール
米国添付文書が改訂され、Contraindicationsに併用禁忌としてフィネレノン、 voclosporin、Warnings and Precautionsの項に併用注意として、mobocertinib、エヌトレクチニ
アメリカ
ブ、ペミガチニブが追加された。
添付文書改
訂(警告・禁
忌)
対応済
273 ブロスマブ(遺伝子組換え)
イスラエルにて、無菌性の問題により、ブロスマブ製剤が回収された。
イスラエル
回収
対応不要
276 アロプリノール
スイスにて、アロプリノール錠の一部のバッチが、スルファメトキサゾール・トリメトプリムが混入した可能性があることから回収された。
スイス
回収
対応不要
279 ピタバスタチンカルシウム
ピタバスタチンの米国添付文書が改訂された。主な内容は以下のとおり。
<Contraindicationsの項>
①急性肝不全あるいは非代償性肝硬変を追記する。
②ピタバスタチンあるいは本剤の賦形剤に対する過敏症を追記する。
<Warnings and Precautionsの項>
③ミオパチーと横紋筋融解症の項に、ミオグロビン尿に続発する急性腎障害が横紋筋融解症の結果として発生する旨、ミオパチーのリスク因子として、特定の薬物の併用
(他の脂質低下療法を含む)、本剤の高用量投与を追記する。
④免疫介在性壊死性ミオパチーの項に、自己免疫性ミオパチーである免疫介在性壊死性ミオパチーは、スタチン使用に関連し、同じまたは異なるスタチンが投与された
場合の再発の報告を含む、まれな報告がある旨、免疫介在性壊死性ミオパシーが疑われた場合は、本剤を中止することを追記する。
⑤肝機能障害の項に、本剤で血清トランスアミナーゼの上昇が報告されている。ほとんどの症例で、これらの変化は開始直後に現れ、一過性であり、症状を伴わず、治療
の継続または治療の短期中断後に消失または改善した旨、本剤は急性肝不全または非代償性肝硬変患者において禁忌である旨を追記する。
<Adverse Reactionsの項>
アメリカ
⑥Clinical Trial Experienceの項のTable.1を記載整備する。
⑦Postmarketing Experienceの項に、眼筋無力症を含む重症筋無力症の新規発症または増悪がまれに報告されており、同じスタチンまたは異なるスタチンを投与した場合
に再発が報告されている旨、扁平苔癬を追記する。
<Use in Specific Populationの項>
⑧Pregnancy、Lactationの項をPLLRに従い変更する。Lactationの項のRisk Summaryに、ヒトまたは動物の乳汁中の本剤の存在、授乳中の乳児に対する本剤の影響、また
は乳汁産生に対する本剤の影響に関する入手可能な情報はない。本剤を含むスタチンは、コレステロール合成、おそらくコレステロール由来の他の生物学的活性物質の
合成を低下させ、授乳中の乳児に害を及ぼす可能性がある。母乳栄養児では重篤な副作用の可能性があるため、作用機序に基づき、本剤による治療中は母乳育児が
推奨されないことを患者に助言することを追記する。
⑨高齢者の項に、高齢者ではミオパチーのリスク増加のため、モニターすることを追記する。
⑩腎障害の項に、腎機能障害のある全ての患者について、ミオパシーの発現をモニタリングすることを追記する。
⑪肝障害の項に、本剤は急性肝不全あるいは非代償性肝硬変患者では禁忌である旨を追記する。
添付文書改
訂(警告・禁
忌)
対応中
回収
対応不要
【第1報】
ドイツにおいて、エボロクマブのオートミニドーザーが注入不能のため、不具合の対象ロットについて回収された。
281 エボロクマブ(遺伝子組換え)
【第2報】
ドイツに流通する使用期限前の全ロットを予防措置として回収することとした。
6
ドイツ
25