よむ、つかう、まなぶ。
【資料4】医薬局からの定期報告[2.0MB] (39 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
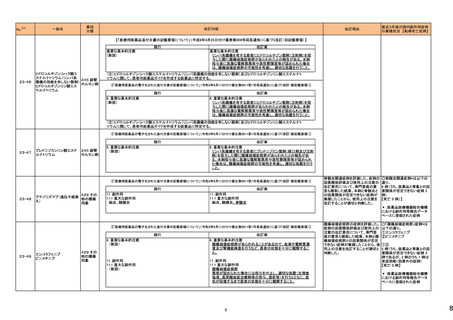
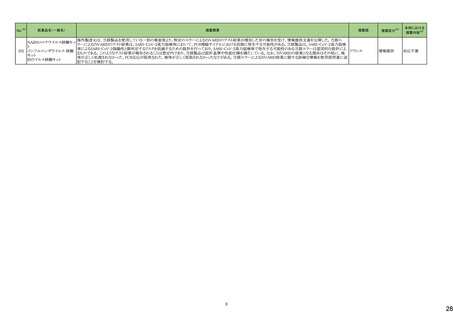
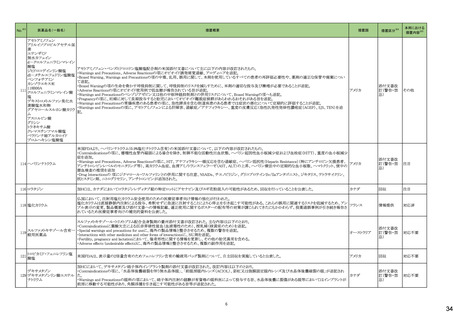
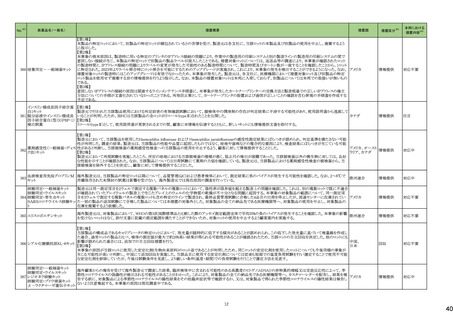
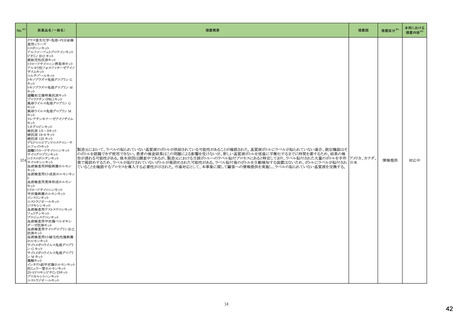
No.※3
275
医薬品名(一般名)
措置概要
措置国
ピリドキシン塩酸塩含有一般
加国において、小児用ビタミン製剤の特定のロットにビタミンB6と葉酸の基準超過が認められたことにより、該当ロットが回収された。
用医薬品
281 バルプロ酸ナトリウム
カナダ
スウェーデンMPAより、受胎前3カ月以内にバルプロ酸による治療を受けた男性の児における神経発達障害の潜在的リスクに関する新たな対策についてのDHPCを入手し
スウェーデン
た。男性患者におけるバルプロ酸使用に関する新たな注意事項や、医療従事者や男性患者向けの教材について記載されている。
措置区分※4
本邦における
措置内容※5
回収
対応不要
情報提供
対応中
288 乾燥BCG膀胱内用(日本株) 梱包段階での調整不良による密封性に関する欠陥により、特定ロットの製剤がリコールされた。
フランス
回収
対応不要
295 タダラフィル
カナダ
回収
対応不要
ラベプラゾールナトリウム・アモ
キシシリン水和物・クラリスロマ
イシン
スイスにおいて、アモキシシリン経口懸濁液用粉末製剤のキャップが正常に取り付けられていないことにより、粉末が漏出する可能性があることから、特定バッチに関するリ
297
スイス
ラベプラゾールナトリウム・アモ コールが実施された。
キシシリン水和物・メトロニダ
ゾール
回収
対応不要
回収
対応不要
307
トロピカミド・フェニレフリン塩
酸塩
加HCは、タダラフィル(効能:勃起不全)の偽造品を押収したことを公表した。
米国FDAは、バイアルにガラス剥離の兆候が認められたためフェニレフリン含有のバイアル製剤について、自主回収を実施していると公表した。
アメリカ
322 リファンピシン
リファンピシン・イソニアジド配合剤のニュージーランド添付文書が改訂された。改訂内容は以下の通り。
・ContraindicationsとInteractions with other medicines and other forms of interactionsの項にリファンピシンとの相互作用による併用禁忌薬としてルラシドンが追記。
・Special warnings and precautions for use及びUndesirable effectsの項に、「イソニアジドの使用による小脳症候群(小脳失調、運動失調、運動障害、平衡障害、眼振、平
衡感覚障害など)が、主に慢性腎臓病患者にみられる。」旨、追記。
添付文書改
ニュージーランド 訂(警告・禁
忌)
対応済
323 デスフルラン
韓国において、輸送ケースの中に虫が確認されたためデスフルラン製剤4ロットについて回収を実施している。
韓国
対応不要
333 ニルマトレルビル・リトナビル
ニュージーランド添付文書が改訂された。改訂内容は以下の通り。
・Contraindicationsの項に、エプレレノン、エレトリプタン、naloxegol、トルバプタン、プリミドンとの併用を追記。
・Undesirable effectsの項に、SJS、TENを追記。
添付文書改
ニュージーランド 訂(警告・禁
忌)
回収
注目
シンガポール規制当局HSAが、プソイドエフェドリン含有製剤の添文について、可逆性後白質脳症症候群(PRES)及び可逆性脳血管収縮症候群(RCVS)に関する注意喚
フェキソフェナジン塩酸塩・塩 起を行う旨を公表した。
343
シンガポール
酸プソイドエフェドリン配合剤 ・Contraindicationsの項に、重度な高血圧患者、重度の腎臓病患者を追記。
・Warnings and Precautions for Useの項に、PRES及びRCVSを追記。
添付文書改
訂(警告・禁
忌)
注目
ドルゾラミド塩酸塩・チモロー
354 ルマレイン酸塩
チモロールマレイン酸塩
回収
対応不要
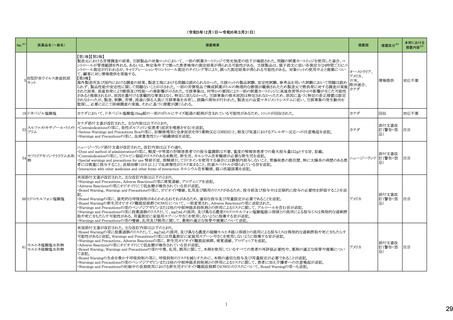
【第1報】
製造元にて実施した安定性試験において、免疫染色試薬の製造後14ヵ月の一部ロットの染色の弱化傾向が確認された。染色の弱化傾向を受けて製造元では予防的に
対象ロットの使用中止と、使用期限を14ヵ月に短縮し14ヵ月を超過して実施した検査は必要に応じて再検査を顧客案内する措置を決定した。 本事象に関する調査は継
アメリカ、
続中であるが、事象が確認されたロットの原材料において、抗体力価が通常よりも低いことが判明した。尚、特定の原材料を用いて製造されたロット以外は実染色試験によ
イギリス、
り当該事象の影響を受けないことを確認している。また、製造元が全世界の苦情を確認したところ、製造元から案内発出時点までに、本事象に関連する苦情は確認されて
フランス、
いない。
オーストラリア、
【第2報】
日本
製造元の調査の結果、本事象は経時的に反応性が低下することに起因しており、当該原材料の受け入れ試験および製品の出荷前試験では検出できず、いずれも規格
を満たしていた。製造元では、特定の原材料について、ロットごとに臨床検体を用いた安定性試験を追加し、製品の使用期限までの各段階においてモニターする予定で
ある。
情報提供
注目
製造元の内部の調査で、当該製品の対象ロットの一部のキットで特定の酵素の分注量が少ないことがわかった。これにより偽陰性となる可能性があるため対象ロットの使
アメリカ、
用中止と廃棄について、顧客に対し情報提供を実施した。製造元で在庫保管ロットをすべて検査し、当該酵素の分注量が少ないものが対象ロットのみであることを確認し
日本
た。製造元にて原因を調査中であるが、一時的な対応として、製造元の製造工程において分注量の検査数を増加している。
情報提供
対応不要
358
B型肝炎ウイルス表面抗体
キット
核酸同定・一般細菌キット
核酸同定・ブドウ球菌キット
359
バンコマイシン耐性遺伝子
キット
米国FDAは、無菌性保証欠如のためチモロール点眼液0.5%(15mL)について、クラスⅡの自主回収を実施していると公表した。
11
アメリカ
39
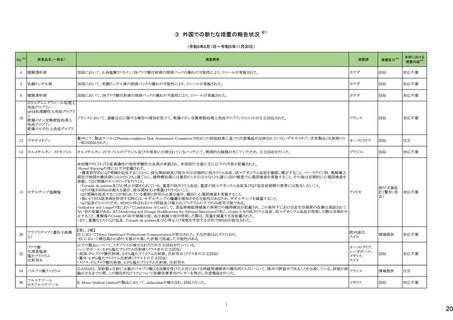
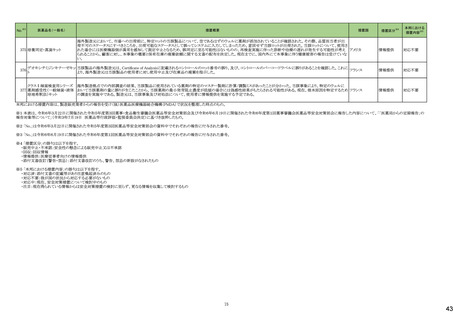
275
医薬品名(一般名)
措置概要
措置国
ピリドキシン塩酸塩含有一般
加国において、小児用ビタミン製剤の特定のロットにビタミンB6と葉酸の基準超過が認められたことにより、該当ロットが回収された。
用医薬品
281 バルプロ酸ナトリウム
カナダ
スウェーデンMPAより、受胎前3カ月以内にバルプロ酸による治療を受けた男性の児における神経発達障害の潜在的リスクに関する新たな対策についてのDHPCを入手し
スウェーデン
た。男性患者におけるバルプロ酸使用に関する新たな注意事項や、医療従事者や男性患者向けの教材について記載されている。
措置区分※4
本邦における
措置内容※5
回収
対応不要
情報提供
対応中
288 乾燥BCG膀胱内用(日本株) 梱包段階での調整不良による密封性に関する欠陥により、特定ロットの製剤がリコールされた。
フランス
回収
対応不要
295 タダラフィル
カナダ
回収
対応不要
ラベプラゾールナトリウム・アモ
キシシリン水和物・クラリスロマ
イシン
スイスにおいて、アモキシシリン経口懸濁液用粉末製剤のキャップが正常に取り付けられていないことにより、粉末が漏出する可能性があることから、特定バッチに関するリ
297
スイス
ラベプラゾールナトリウム・アモ コールが実施された。
キシシリン水和物・メトロニダ
ゾール
回収
対応不要
回収
対応不要
307
トロピカミド・フェニレフリン塩
酸塩
加HCは、タダラフィル(効能:勃起不全)の偽造品を押収したことを公表した。
米国FDAは、バイアルにガラス剥離の兆候が認められたためフェニレフリン含有のバイアル製剤について、自主回収を実施していると公表した。
アメリカ
322 リファンピシン
リファンピシン・イソニアジド配合剤のニュージーランド添付文書が改訂された。改訂内容は以下の通り。
・ContraindicationsとInteractions with other medicines and other forms of interactionsの項にリファンピシンとの相互作用による併用禁忌薬としてルラシドンが追記。
・Special warnings and precautions for use及びUndesirable effectsの項に、「イソニアジドの使用による小脳症候群(小脳失調、運動失調、運動障害、平衡障害、眼振、平
衡感覚障害など)が、主に慢性腎臓病患者にみられる。」旨、追記。
添付文書改
ニュージーランド 訂(警告・禁
忌)
対応済
323 デスフルラン
韓国において、輸送ケースの中に虫が確認されたためデスフルラン製剤4ロットについて回収を実施している。
韓国
対応不要
333 ニルマトレルビル・リトナビル
ニュージーランド添付文書が改訂された。改訂内容は以下の通り。
・Contraindicationsの項に、エプレレノン、エレトリプタン、naloxegol、トルバプタン、プリミドンとの併用を追記。
・Undesirable effectsの項に、SJS、TENを追記。
添付文書改
ニュージーランド 訂(警告・禁
忌)
回収
注目
シンガポール規制当局HSAが、プソイドエフェドリン含有製剤の添文について、可逆性後白質脳症症候群(PRES)及び可逆性脳血管収縮症候群(RCVS)に関する注意喚
フェキソフェナジン塩酸塩・塩 起を行う旨を公表した。
343
シンガポール
酸プソイドエフェドリン配合剤 ・Contraindicationsの項に、重度な高血圧患者、重度の腎臓病患者を追記。
・Warnings and Precautions for Useの項に、PRES及びRCVSを追記。
添付文書改
訂(警告・禁
忌)
注目
ドルゾラミド塩酸塩・チモロー
354 ルマレイン酸塩
チモロールマレイン酸塩
回収
対応不要
【第1報】
製造元にて実施した安定性試験において、免疫染色試薬の製造後14ヵ月の一部ロットの染色の弱化傾向が確認された。染色の弱化傾向を受けて製造元では予防的に
対象ロットの使用中止と、使用期限を14ヵ月に短縮し14ヵ月を超過して実施した検査は必要に応じて再検査を顧客案内する措置を決定した。 本事象に関する調査は継
アメリカ、
続中であるが、事象が確認されたロットの原材料において、抗体力価が通常よりも低いことが判明した。尚、特定の原材料を用いて製造されたロット以外は実染色試験によ
イギリス、
り当該事象の影響を受けないことを確認している。また、製造元が全世界の苦情を確認したところ、製造元から案内発出時点までに、本事象に関連する苦情は確認されて
フランス、
いない。
オーストラリア、
【第2報】
日本
製造元の調査の結果、本事象は経時的に反応性が低下することに起因しており、当該原材料の受け入れ試験および製品の出荷前試験では検出できず、いずれも規格
を満たしていた。製造元では、特定の原材料について、ロットごとに臨床検体を用いた安定性試験を追加し、製品の使用期限までの各段階においてモニターする予定で
ある。
情報提供
注目
製造元の内部の調査で、当該製品の対象ロットの一部のキットで特定の酵素の分注量が少ないことがわかった。これにより偽陰性となる可能性があるため対象ロットの使
アメリカ、
用中止と廃棄について、顧客に対し情報提供を実施した。製造元で在庫保管ロットをすべて検査し、当該酵素の分注量が少ないものが対象ロットのみであることを確認し
日本
た。製造元にて原因を調査中であるが、一時的な対応として、製造元の製造工程において分注量の検査数を増加している。
情報提供
対応不要
358
B型肝炎ウイルス表面抗体
キット
核酸同定・一般細菌キット
核酸同定・ブドウ球菌キット
359
バンコマイシン耐性遺伝子
キット
米国FDAは、無菌性保証欠如のためチモロール点眼液0.5%(15mL)について、クラスⅡの自主回収を実施していると公表した。
11
アメリカ
39