よむ、つかう、まなぶ。
【資料4】医薬局からの定期報告[2.0MB] (29 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
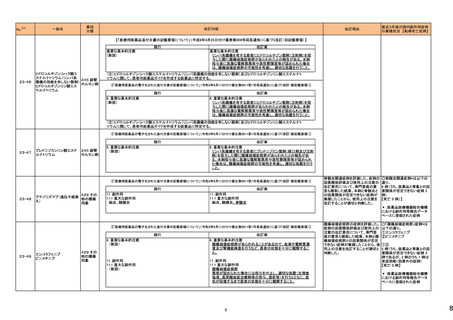
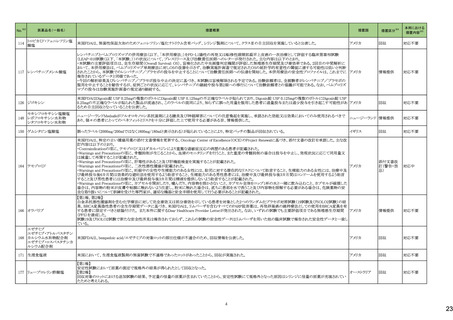
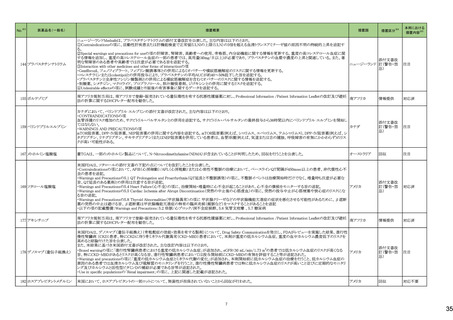
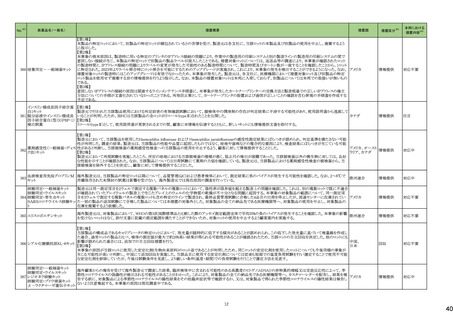
(令和5年12月1日~令和6年3月31日)
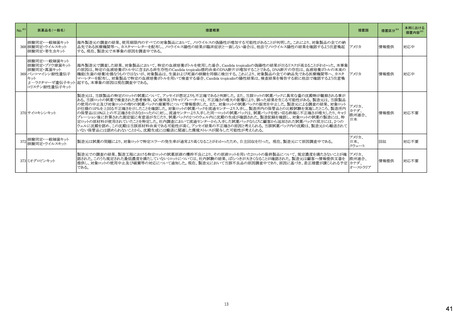
No.※3
医薬品名(一般名)
措置概要
措置国
措置区分※4
本邦における
※5
措置内容
【第1報】【第2報】
製造元における苦情調査の結果、当該製品の対象ロットにおいて、一部の試薬カートリッジで発光強度の低下が確認された。問題の試薬カートリッジを使用した場合、コ
ントロールが管理範囲を外れる、あるいは、特定条件下で誤った患者検体の測定結果が得られる可能性がある。 当該製品は、電子添文に従い各測定日(24時間ごと)にコ
ントロール測定が行われるが、キャリブレーションやコントロール測定のタイミング等により、誤った測定結果が得られる可能性がある。 対象ロットの使用中止と廃棄につい
オーストラリア、
て、顧客に対し情報提供を実施する。
アメリカ、
【第3報】
日本、
海外製造所及び国内における調査の結果、製造工程における問題は認められなかった。当該ロットの製品試験、安定性試験、参考品を用いた試験において問題は認め
欧州連合、
られず、製品性能や安定性に関して問題ないことが示された。一部の苦情現品で構成試薬ボトルの物理的な膨張が観察されたため製造元で熱負荷に対する調査が実施
カナダ
された結果、高温負荷により膨張及び性能への悪影響が示された。当該事象は、何等かの要因により一部の試薬カートリッジに高温負荷等がかかり影響が生じた可能性
があると推察されるが、原因を裏付ける客観的な事実はなく、特定に至らなかった。当該事象の根本原因は特定されなかったため、原因に基づく特定の是正措置は設定
されなかったが、製造、試験、苦情、流通に係る人員に当該事象を共有し、認識の周知が行われた。製造元の品質マネジメントシステムに従い、当該事象の発生動向を
監視し、必要に応じて詳細調査の実施、それに基づく措置が講じられる。
情報提供
対応不要
カナダにおいて、ドネペジル塩酸塩10mg錠の一部のボトルにサイズ超過の錠剤が含まれている可能性があるため、1ロットが回収された。
カナダ
回収
対応不要
カナダ
添付文書改
訂(警告・禁
忌)
注目
ニュージーランド添付文書が改訂された。改訂内容は以下の通り。
・Dose and method of administrationの項に、軽度・中等度の肝障害患者での投与量調節は不要、重度の腎障害患者での最大投与量は2gとする旨、記載。
添付文書改
セフトリアキソンナトリウム水和 ・Contraindicationの項に、ビリルビン脳症のリスクのある未熟児、新生児、カルシウム含有輸液が必要な新生児を追記。
54
ニュージーランド 訂(警告・禁
物
・Special warnings and precautions for use 腎結石症、溶解液としてリドカインを使用する場合には静脈内投与しないこと、胃腸疾患の既往歴、特に大腸炎の病歴のある患
忌)
者には慎重に投与すること、長期治療(10日以上)で血液毒性がリスク高まること、抗菌スペクトルが限られている旨を追記。
・Interaction with other medicines and other forms of interaction カルシウム含有輸液、経口抗凝固薬を追記。
注目
5
B型肝炎ウイルス表面抗原
キット
19 ドネペジル塩酸塩
カナダ添付文書が改訂された。主な内容は以下のとおり。
スルファメトキサゾール・トリメト ・Contraindicationsの項に、急性ポルフィリン症患者(症状を増悪させる)を追記。
53
プリム
・Serious Warnings and Precautions Boxの項に、好酸球増加と全身症状を伴う薬物反応(DRESS)と、肺及び気道におけるアレルギー反応への注意喚起を追記。
・Warnings and Precautionsの項に、血球貪食性リンパ組織球症を追記。
60 ヒドロモルフォン塩酸塩
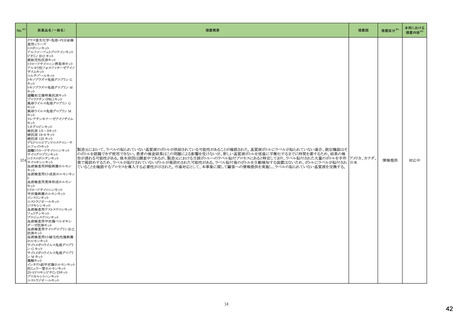
米国添付文書が改訂された。主な改訂内容は以下のとおり。
・Warnings and Precautions、Adverse Reactionsの項に痛覚過敏、アロディニアを追記。
・Adverse Reactionsの項にオピオイドにて低血糖が報告されている旨が追記。
・Boxed Warning、Warnings and Precautionsの項に、オピオイド嗜癖、乱用及び誤用のリスクがあるため、投与前及び投与中は定期的に投与の必要性を評価することを追
記。
・Boxed Warningの項に、致死的な呼吸抑制があらわれるおそれがあるため、適切な投与及び用量設定が必要であることを追記。
アメリカ
・Boxed Warningの新生児オピオイド離脱症候群(NOWS)について、一部変更され、Adverse Reactionsの項に追記された。
・Warnings and Precautionsの項のベンゾジアゼピンまたは他の中枢神経系抑制剤との併用によるリスクに関して、アルコールを含む旨が追記。
・Warnings and Precautionsの項に投薬過誤のリスクとして、mgとmLの混同、及び異なる濃度のヒドロモルフォン塩酸塩経口溶液との混同による投与ミスは偶発的な過剰摂
取や死亡をもたらす可能性がある、用量測定に家庭用スプーンやさじを使用しないように指導する旨が追記。
・Warnings and Precautionsの項の嗜癖、乱用及び誤用に関して、薬剤の適正な保管や廃棄について追記。
添付文書改
訂(警告・禁
忌)
注目
モルヒネ塩酸塩水和物
モルヒネ硫酸塩水和物
米国添付文書が改訂された。主な改訂内容は以下のとおり。
・Boxed Warningの項に投薬過誤のリスクとして、mgとmLの混同、及び異なる濃度の硫酸モルヒネ経口溶液との混同による投与ミスは偶発的な過剰摂取や死亡をもたらす
可能性があると追記。Warnings and Precautionsの項には用量測定に家庭用スプーンやさじを使用しないように指導する旨が追記。
・Warnings and Precautions、Adverse Reactionsの項に、新生児オピオイド離脱症候群、痛覚過敏、アロディニアを追記。
・Adverse Reactionsの項にオピオイドにて低血糖が報告されている旨が追記。
アメリカ
・Boxed Warning、Warnings and Precautionsの項の中毒、乱用、誤用に関して、本剤を使用しているすべての患者の再評価必要性や、薬剤の適正な保管や廃棄につい
て追記。
・Boxed Warningの生命を脅かす呼吸抑制の項に、呼吸抑制のリスクを減らすために、本剤の適切な投与及び用量設定が必要であることが追記。
・Warnings and Precautionsの項のベンゾジアゼピンまたは他の中枢神経系抑制剤との併用によるリスクに関して、患者に加え介護者への注意喚起が追記。
・Warnings and Precautionsの妊娠中の長期使用における新生児オピオイド離脱症候群(NOWS)のリスクについて、Boxed Warningの項へも追記。
添付文書改
訂(警告・禁
忌)
注目
61
1
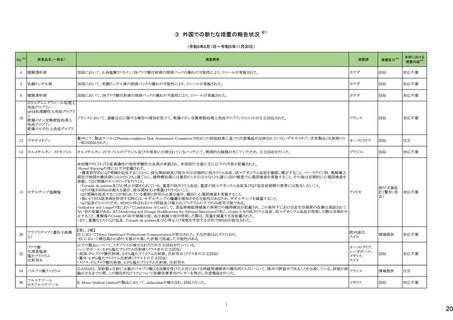
29
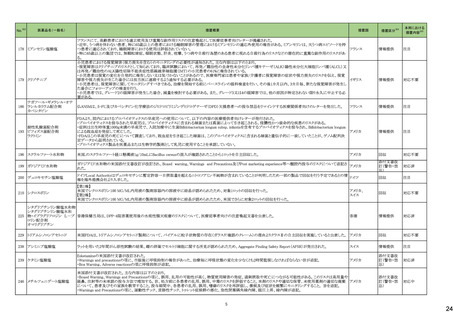
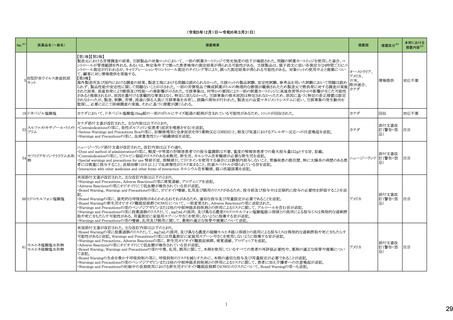
No.※3
医薬品名(一般名)
措置概要
措置国
措置区分※4
本邦における
※5
措置内容
【第1報】【第2報】
製造元における苦情調査の結果、当該製品の対象ロットにおいて、一部の試薬カートリッジで発光強度の低下が確認された。問題の試薬カートリッジを使用した場合、コ
ントロールが管理範囲を外れる、あるいは、特定条件下で誤った患者検体の測定結果が得られる可能性がある。 当該製品は、電子添文に従い各測定日(24時間ごと)にコ
ントロール測定が行われるが、キャリブレーションやコントロール測定のタイミング等により、誤った測定結果が得られる可能性がある。 対象ロットの使用中止と廃棄につい
オーストラリア、
て、顧客に対し情報提供を実施する。
アメリカ、
【第3報】
日本、
海外製造所及び国内における調査の結果、製造工程における問題は認められなかった。当該ロットの製品試験、安定性試験、参考品を用いた試験において問題は認め
欧州連合、
られず、製品性能や安定性に関して問題ないことが示された。一部の苦情現品で構成試薬ボトルの物理的な膨張が観察されたため製造元で熱負荷に対する調査が実施
カナダ
された結果、高温負荷により膨張及び性能への悪影響が示された。当該事象は、何等かの要因により一部の試薬カートリッジに高温負荷等がかかり影響が生じた可能性
があると推察されるが、原因を裏付ける客観的な事実はなく、特定に至らなかった。当該事象の根本原因は特定されなかったため、原因に基づく特定の是正措置は設定
されなかったが、製造、試験、苦情、流通に係る人員に当該事象を共有し、認識の周知が行われた。製造元の品質マネジメントシステムに従い、当該事象の発生動向を
監視し、必要に応じて詳細調査の実施、それに基づく措置が講じられる。
情報提供
対応不要
カナダにおいて、ドネペジル塩酸塩10mg錠の一部のボトルにサイズ超過の錠剤が含まれている可能性があるため、1ロットが回収された。
カナダ
回収
対応不要
カナダ
添付文書改
訂(警告・禁
忌)
注目
ニュージーランド添付文書が改訂された。改訂内容は以下の通り。
・Dose and method of administrationの項に、軽度・中等度の肝障害患者での投与量調節は不要、重度の腎障害患者での最大投与量は2gとする旨、記載。
添付文書改
セフトリアキソンナトリウム水和 ・Contraindicationの項に、ビリルビン脳症のリスクのある未熟児、新生児、カルシウム含有輸液が必要な新生児を追記。
54
ニュージーランド 訂(警告・禁
物
・Special warnings and precautions for use 腎結石症、溶解液としてリドカインを使用する場合には静脈内投与しないこと、胃腸疾患の既往歴、特に大腸炎の病歴のある患
忌)
者には慎重に投与すること、長期治療(10日以上)で血液毒性がリスク高まること、抗菌スペクトルが限られている旨を追記。
・Interaction with other medicines and other forms of interaction カルシウム含有輸液、経口抗凝固薬を追記。
注目
5
B型肝炎ウイルス表面抗原
キット
19 ドネペジル塩酸塩
カナダ添付文書が改訂された。主な内容は以下のとおり。
スルファメトキサゾール・トリメト ・Contraindicationsの項に、急性ポルフィリン症患者(症状を増悪させる)を追記。
53
プリム
・Serious Warnings and Precautions Boxの項に、好酸球増加と全身症状を伴う薬物反応(DRESS)と、肺及び気道におけるアレルギー反応への注意喚起を追記。
・Warnings and Precautionsの項に、血球貪食性リンパ組織球症を追記。
60 ヒドロモルフォン塩酸塩
米国添付文書が改訂された。主な改訂内容は以下のとおり。
・Warnings and Precautions、Adverse Reactionsの項に痛覚過敏、アロディニアを追記。
・Adverse Reactionsの項にオピオイドにて低血糖が報告されている旨が追記。
・Boxed Warning、Warnings and Precautionsの項に、オピオイド嗜癖、乱用及び誤用のリスクがあるため、投与前及び投与中は定期的に投与の必要性を評価することを追
記。
・Boxed Warningの項に、致死的な呼吸抑制があらわれるおそれがあるため、適切な投与及び用量設定が必要であることを追記。
アメリカ
・Boxed Warningの新生児オピオイド離脱症候群(NOWS)について、一部変更され、Adverse Reactionsの項に追記された。
・Warnings and Precautionsの項のベンゾジアゼピンまたは他の中枢神経系抑制剤との併用によるリスクに関して、アルコールを含む旨が追記。
・Warnings and Precautionsの項に投薬過誤のリスクとして、mgとmLの混同、及び異なる濃度のヒドロモルフォン塩酸塩経口溶液との混同による投与ミスは偶発的な過剰摂
取や死亡をもたらす可能性がある、用量測定に家庭用スプーンやさじを使用しないように指導する旨が追記。
・Warnings and Precautionsの項の嗜癖、乱用及び誤用に関して、薬剤の適正な保管や廃棄について追記。
添付文書改
訂(警告・禁
忌)
注目
モルヒネ塩酸塩水和物
モルヒネ硫酸塩水和物
米国添付文書が改訂された。主な改訂内容は以下のとおり。
・Boxed Warningの項に投薬過誤のリスクとして、mgとmLの混同、及び異なる濃度の硫酸モルヒネ経口溶液との混同による投与ミスは偶発的な過剰摂取や死亡をもたらす
可能性があると追記。Warnings and Precautionsの項には用量測定に家庭用スプーンやさじを使用しないように指導する旨が追記。
・Warnings and Precautions、Adverse Reactionsの項に、新生児オピオイド離脱症候群、痛覚過敏、アロディニアを追記。
・Adverse Reactionsの項にオピオイドにて低血糖が報告されている旨が追記。
アメリカ
・Boxed Warning、Warnings and Precautionsの項の中毒、乱用、誤用に関して、本剤を使用しているすべての患者の再評価必要性や、薬剤の適正な保管や廃棄につい
て追記。
・Boxed Warningの生命を脅かす呼吸抑制の項に、呼吸抑制のリスクを減らすために、本剤の適切な投与及び用量設定が必要であることが追記。
・Warnings and Precautionsの項のベンゾジアゼピンまたは他の中枢神経系抑制剤との併用によるリスクに関して、患者に加え介護者への注意喚起が追記。
・Warnings and Precautionsの妊娠中の長期使用における新生児オピオイド離脱症候群(NOWS)のリスクについて、Boxed Warningの項へも追記。
添付文書改
訂(警告・禁
忌)
注目
61
1
29