よむ、つかう、まなぶ。
【資料4】医薬局からの定期報告[2.0MB] (43 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
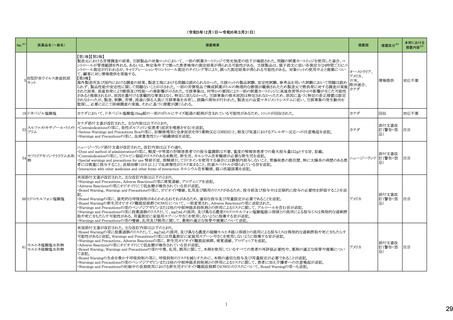
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
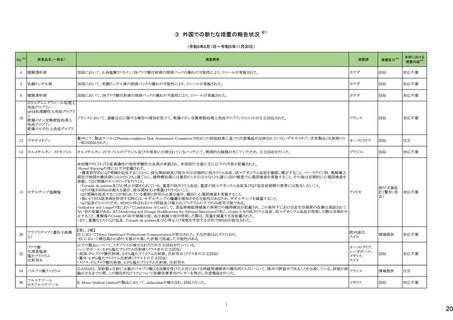
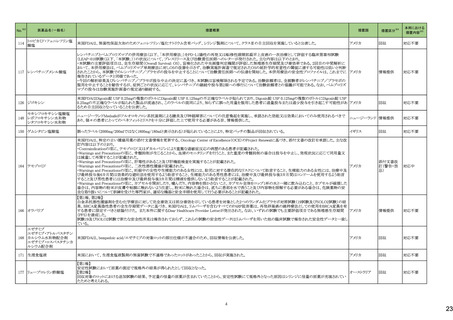
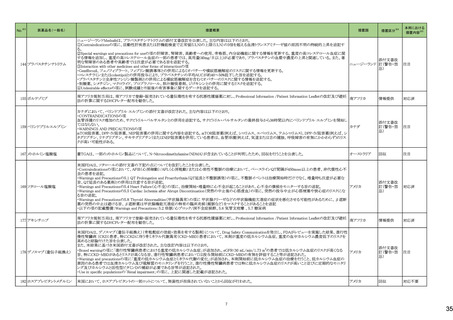
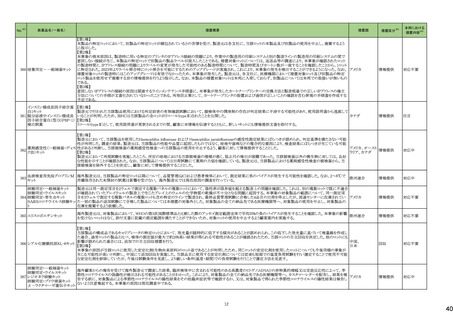
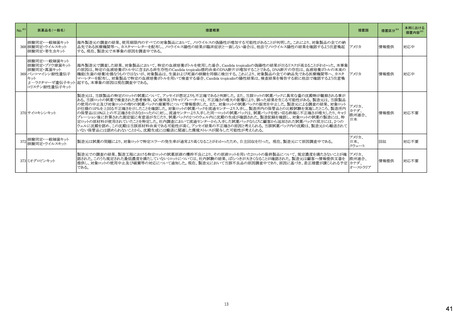
No.※3
医薬品名(一般名)
措置概要
措置国
措置区分※4
本邦における
措置内容※5
海外製造元において、市場への出荷前に、特定ロットの当該製品について、空であるはずのウェルに薬剤が添加されていることが確認された。その際、品質担当者が出
荷不可のステータスにすべきところを、出荷可能なステータスとして誤ってシステムに入力してしまったため、意図せず当該ロットが出荷された。当該ロットについて、使用さ
れた場合には医療機器側が異常を感知して測定中止となるため、誤同定に至る可能性はないものの、再検査実施に伴った診断や治療の遅れが発生する可能性が考え アメリカ
られることから、顧客に対し、本事象の概要と保有在庫の廃棄依頼に関する文書の配布を決定した。現在までに、国内外にて本事象に伴う健康被害の報告は受けていな
い。
情報提供
対応不要
デオキシチミジンキナーゼキッ 当該製品の海外製造元は、Certificate of Analysisに記載されるコントロールのロット番号の誤り、及び、コントロールのバーコードラベルに誤りがあることを確認した。これに
フランス
ト
より、海外製造元は当該製品の使用者に対し使用中止及び在庫品の廃棄を指示した。
情報提供
対応不要
クラスⅠ細菌検査用シリーズ 海外製造拠点での内部調査の結果、当該製品に使用されている薬剤の特定のマスター製剤に計算/調製ミスがあったことが分かった。当該事象により、特定のウェルに
377 薬剤感受性(一般細菌・液体 おいて当該薬剤の量に誤りが生じたことから、当該薬剤の最小発育阻止濃度が低値の場合には偽感性結果がもたらされる可能性がある。現在、根本原因を特定するため フランス
培地希釈法)キット
の調査を実施中である。製造元は、当該事象及び対処法について、使用者に情報提供を実施する予定である。
情報提供
対応不要
375 培養同定・真菌キット
376
本邦における措置内容は、製造販売業者からの報告を受け(独)医薬品医療機器総合機構(PMDA)で状況を整理した時点のもの。
※1 本表は、令和6年3月22日に開催された令和5年度第3回薬事・食品衛生審議会医薬品等安全対策部会及び令和6年6月19日に開催された令和6年度第1回薬事審議会医薬品等安全対策部会に報告した内容について、「「医薬局からの定期報告」の
報告対象等について」(令和3年7月19日 医薬品等行政評価・監視委員会決定)に基づき抜粋したもの。
※2 「No.」は令和6年3月22日に開催された令和5年度第3回医薬品等安全対策部会の資料中でそれぞれの報告に付与された番号。
※3 「No.」は令和6年6月19日に開催された令和6年度第1回医薬品等安全対策部会の資料中でそれぞれの報告に付与された番号。
※4 「措置区分」の語句は以下を指す。
・販売中止・不承認:安全性の懸念による販売中止又は不承認
・回収:回収情報
・情報提供:医療従事者向けの情報提供
・添付文書改訂(警告・禁忌):添付文書改訂のうち、警告、禁忌の新設がなされたもの
※5 「本邦における措置内容」の語句は以下を指す。
・対応済:添付文書の記載等があり注意喚起済みのもの
・対応不要:我が国の状況から対応する必要がないもの
・対応中:現在、安全対策措置について検討中のもの
・注目:現在得られている情報からは安全対策措置の検討に至らず、更なる情報を収集して検討するもの
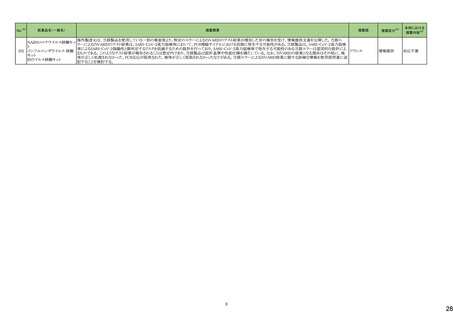
15
43
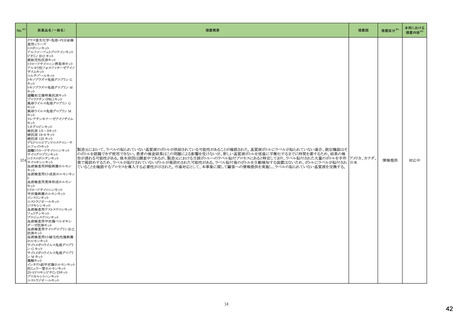
医薬品名(一般名)
措置概要
措置国
措置区分※4
本邦における
措置内容※5
海外製造元において、市場への出荷前に、特定ロットの当該製品について、空であるはずのウェルに薬剤が添加されていることが確認された。その際、品質担当者が出
荷不可のステータスにすべきところを、出荷可能なステータスとして誤ってシステムに入力してしまったため、意図せず当該ロットが出荷された。当該ロットについて、使用さ
れた場合には医療機器側が異常を感知して測定中止となるため、誤同定に至る可能性はないものの、再検査実施に伴った診断や治療の遅れが発生する可能性が考え アメリカ
られることから、顧客に対し、本事象の概要と保有在庫の廃棄依頼に関する文書の配布を決定した。現在までに、国内外にて本事象に伴う健康被害の報告は受けていな
い。
情報提供
対応不要
デオキシチミジンキナーゼキッ 当該製品の海外製造元は、Certificate of Analysisに記載されるコントロールのロット番号の誤り、及び、コントロールのバーコードラベルに誤りがあることを確認した。これに
フランス
ト
より、海外製造元は当該製品の使用者に対し使用中止及び在庫品の廃棄を指示した。
情報提供
対応不要
クラスⅠ細菌検査用シリーズ 海外製造拠点での内部調査の結果、当該製品に使用されている薬剤の特定のマスター製剤に計算/調製ミスがあったことが分かった。当該事象により、特定のウェルに
377 薬剤感受性(一般細菌・液体 おいて当該薬剤の量に誤りが生じたことから、当該薬剤の最小発育阻止濃度が低値の場合には偽感性結果がもたらされる可能性がある。現在、根本原因を特定するため フランス
培地希釈法)キット
の調査を実施中である。製造元は、当該事象及び対処法について、使用者に情報提供を実施する予定である。
情報提供
対応不要
375 培養同定・真菌キット
376
本邦における措置内容は、製造販売業者からの報告を受け(独)医薬品医療機器総合機構(PMDA)で状況を整理した時点のもの。
※1 本表は、令和6年3月22日に開催された令和5年度第3回薬事・食品衛生審議会医薬品等安全対策部会及び令和6年6月19日に開催された令和6年度第1回薬事審議会医薬品等安全対策部会に報告した内容について、「「医薬局からの定期報告」の
報告対象等について」(令和3年7月19日 医薬品等行政評価・監視委員会決定)に基づき抜粋したもの。
※2 「No.」は令和6年3月22日に開催された令和5年度第3回医薬品等安全対策部会の資料中でそれぞれの報告に付与された番号。
※3 「No.」は令和6年6月19日に開催された令和6年度第1回医薬品等安全対策部会の資料中でそれぞれの報告に付与された番号。
※4 「措置区分」の語句は以下を指す。
・販売中止・不承認:安全性の懸念による販売中止又は不承認
・回収:回収情報
・情報提供:医療従事者向けの情報提供
・添付文書改訂(警告・禁忌):添付文書改訂のうち、警告、禁忌の新設がなされたもの
※5 「本邦における措置内容」の語句は以下を指す。
・対応済:添付文書の記載等があり注意喚起済みのもの
・対応不要:我が国の状況から対応する必要がないもの
・対応中:現在、安全対策措置について検討中のもの
・注目:現在得られている情報からは安全対策措置の検討に至らず、更なる情報を収集して検討するもの
15
43