よむ、つかう、まなぶ。
【資料4】医薬局からの定期報告[2.0MB] (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
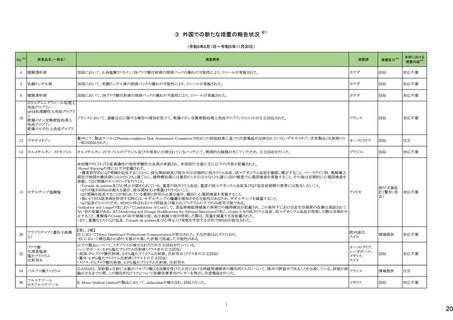
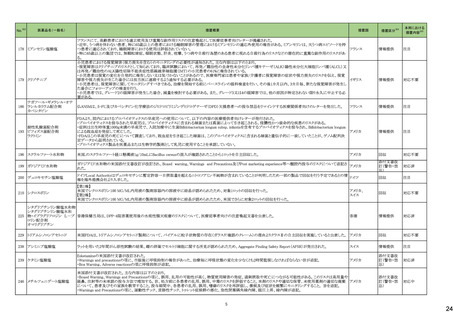
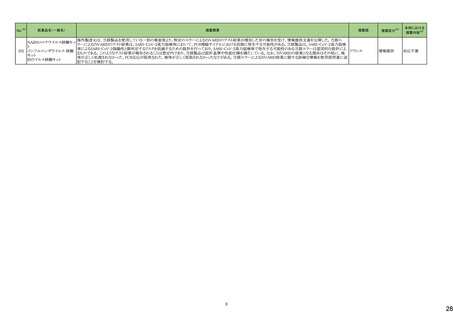
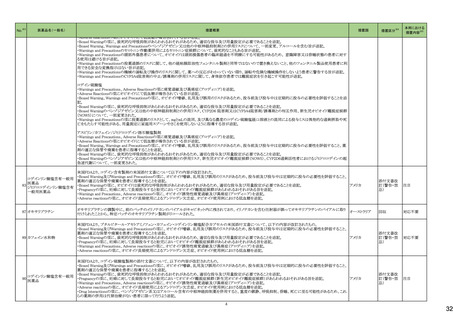
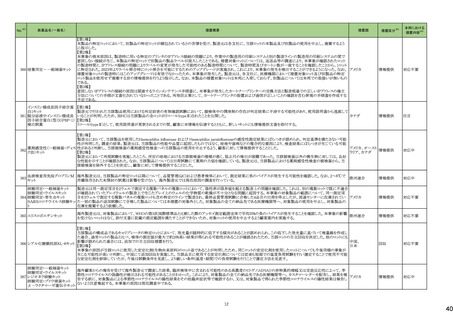
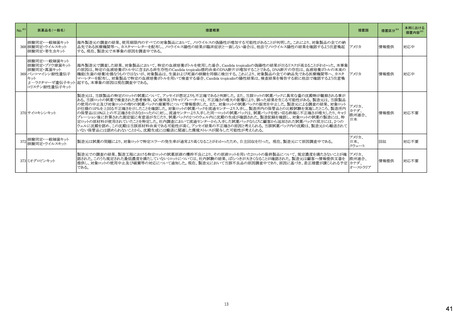
No.※2
医薬品名(一般名)
措置概要
措置国
措置区分※4
本邦における
措置内容※5
43
ロスバスタチンカルシウム
エゼチミブ・ロスバスタチンカ
ルシウム配合剤
ロスバスタチンの米国添付文書が改訂された。主な内容は以下のとおり。
①Contraindicationsの項に、急性肝不全または代償性肝硬変を追記する。
②Warnings and PrecautionsのMyopathy and Rhabdomyolysisの項に、ミオパチーと横紋筋融解症のリスク因子、リスク回避またはリスク低減に関する内容を追記する。
③Warnings and Precautionsの Immune-Mediated Necrotizing Myopathyの項に、スタチン使用に関連する免疫介在性壊死性ミオパチーについて、同じまたは他のスタチ
ン投与時に再発する報告がある旨を追記する。
④Warnings and Precautionsの Hepatic Dysfunctionの項に、ロスバスタチンの使用による血清トランスアミナーゼの上昇について、ほとんどの場合は投与開始直後より発
現し、一過性で症状を伴わないこと、肝酵素検査を投与開始前、その後も臨床的に適応される場合に実施する旨を追記する。
⑤Warnings and PrecautionsのIncreases in HbA1c and Fasting Serum Glucose Levelsの項に、定期的な運動、健康的な体重の維持、健康的な食事を含むライフスタイル
の最適化を追記する。
⑥Adverse Reactionsの項に、免疫介在性壊死性ミオパチー、肝機能障害、蛋白尿と血尿を追記する。
⑦Adverse ReactionsのPostmarketing Experienceの項に、眼筋無力症を含む重症筋無力症の新規発症または増悪がまれに報告されており、同じスタチンまたは別のスタ
チンを投与した場合に再発したとの報告もある旨を追記する。
⑧Adverse ReactionsのPostmarketing Experienceの項に、好酸球増加と全身症状を伴う薬物反応(DRESS)、苔癬様薬疹を追記する。
アメリカ
⑨Drug Interactionsの項に、ロスバスタチンはCYP2C9およびトランスポーター(OATP1B1、BCRPなど)の基質である。CYP2C9およびトランスポーターの阻害剤との併用に
より、ロスバスタチンの血漿中濃度が有意に上昇する可能性がある旨を追記する。
⑩Drug Interactionsの項に、併用によりロスバスタチンの効果を減少させる薬剤について、水酸化マグネシウム・水酸化アルミニウム、その他の薬剤としてワルファリンを追
記する。
⑪Pediatric Useの項に、8歳未満のHeFHの小児患者、7歳未満のHoFHの小児患者、または他のタイプの高脂血症(HeFHまたはHoFH以外)の小児患者におけるロスバ
スタチンの安全性および有効性は確立されていない旨を追記する。
⑫Geriatric Useの項に、高齢者(65歳以上)はミオパチーのリスク因子である旨を追記する。
⑬Renal Impairmentの項に、腎機能障害はミオパチーと横紋筋融解症のリスクである旨を追記する。
⑭Hepatic Impairmentの項に、ロスバスタチンは急性肝不全あるいは代償性肝硬変患者では禁忌である旨を追記する。
⑮Pregnancyの項に、妊娠が確認された場合は、ロスバスタチンを中止してください。あるいは、個々の患者における治療の継続の必要性を考慮する旨を追記する。
⑯Lactationの項に、作用機序に基づき、授乳中の乳児に重篤な有害事象が発現する可能性があるため、ロスバスタチンの治療中は授乳が推奨されないことを患者に助
言する旨を追記する。
48
アミトリプチリン塩酸塩
加HCは、許容限度値を超えるN-nitroso-nortriptyline(NNORT)が検出されたため、Apotex社のアミトリプチリン10mg錠/25mg錠の特定ロットがリコールされたことを公表し
カナダ
た。
回収
対応不要
49
アシクロビル
カナダにおいて、許容レベルを超えるnitrosamine不純物(NDMA)のため、Apo-Acyclovir錠200mg/400mg/800mgの特定ロットを回収している。
回収
対応不要
50
アミトリプチリン塩酸塩
シンガポール HSAは、許容限度値を超えるN-nitroso-nortriptyline(NNORT)が検出されたため、Pharmaforte Singapore社のアミトリプチリン10mg錠の特定ロットがリコール
シンガポール
されたことを公表した。
回収
対応不要
51
アシクロビル
シンガポールにおいて、許容レベルを超えるnitrosamine不純物(NDMA)のため、Apo-Acyclovir錠200mg/400mg/800mgの特定ロットを回収している。
シンガポール
回収
対応不要
53
トロピカミド・フェニレフリン塩
酸塩
米国FDAは、無菌性保証欠如のためCentral Admixture Pharmacy Services社のフェニレフリン/塩化ナトリウム含有バッグ、シリンジ製剤について、クラスⅡの自主回収を
実施していると公表した。
アメリカ
回収
対応不要
トラスツズマブ(遺伝子組換
え)
【第1報】
添付文書の同梱が欠落している可能性についてEUでDirect healthcare professional communicationが発出された。
【第2報】
添付文書の同梱が欠落している可能性についてスウェーデンでDirect healthcare professional communicationが発出された。
欧州連合、
スウェーデン
情報提供
対応不要
カナダ
添付文書改
訂(警告・禁
忌)
対応不要
アメリカ
添付文書改
訂(警告・禁
忌)
対応済
59
65
71
塩化カリウム含有一般用医薬
品
カナダにおいて、アミノ酸・電解質・ブドウ糖・脂質を含有する静脈内投与製剤の添付文書が改訂された。
塩化ナトリウム含有一般用医 ・Contraindicationsの項に、卵、大豆製品、落花生製品、オリーブ製品、有効成分、賦形剤に対する過敏症のある患者が追記。
薬品
クラリスロマイシン
ラベプラゾールナトリウム・アモ
クラリスロマイシン含有製剤の米国添付文書が改訂され、ContraindicationsのSerious Drug Interactionsの項に、ルラシドンが追記された。
キシシリン水和物・クラリスロマ
イシン
カナダ
添付文書改
訂(警告・禁
忌)
対応中
76
アシクロビル
【第1報、第2報、第3報】シンガポールにおいて、Apotex Inc.のアシクロビル錠(力価400mg、800mg)の特定ロットについて、許容レベルを超えるニトロソアミン不純物が含ま
シンガポール
れるとして回収されている。
回収
対応不要
82
モンテルカストナトリウム
カナダにおいて、モンテルカストナトリウム製剤から基準値を超える不純物が検出されたため製品回収がされたもの。
カナダ
回収
対応不要
85
リファンピシン
米国添付文書が改訂され、Contraindications、Drug interactions の項に併用禁忌としてルラシドンが追記された。
アメリカ
添付文書改
訂(警告・禁
忌)
対応済
2
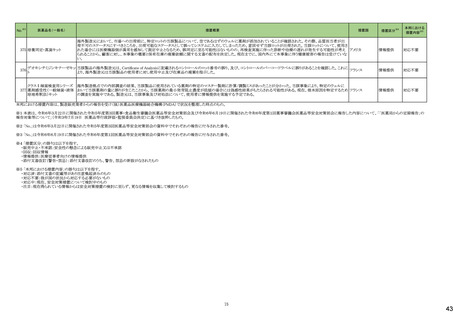
21
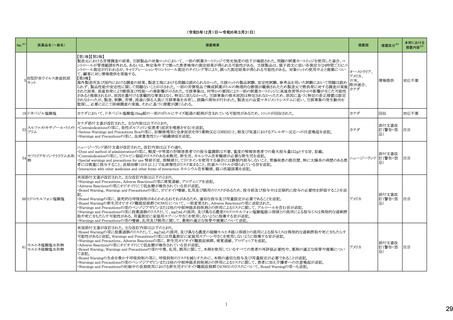
医薬品名(一般名)
措置概要
措置国
措置区分※4
本邦における
措置内容※5
43
ロスバスタチンカルシウム
エゼチミブ・ロスバスタチンカ
ルシウム配合剤
ロスバスタチンの米国添付文書が改訂された。主な内容は以下のとおり。
①Contraindicationsの項に、急性肝不全または代償性肝硬変を追記する。
②Warnings and PrecautionsのMyopathy and Rhabdomyolysisの項に、ミオパチーと横紋筋融解症のリスク因子、リスク回避またはリスク低減に関する内容を追記する。
③Warnings and Precautionsの Immune-Mediated Necrotizing Myopathyの項に、スタチン使用に関連する免疫介在性壊死性ミオパチーについて、同じまたは他のスタチ
ン投与時に再発する報告がある旨を追記する。
④Warnings and Precautionsの Hepatic Dysfunctionの項に、ロスバスタチンの使用による血清トランスアミナーゼの上昇について、ほとんどの場合は投与開始直後より発
現し、一過性で症状を伴わないこと、肝酵素検査を投与開始前、その後も臨床的に適応される場合に実施する旨を追記する。
⑤Warnings and PrecautionsのIncreases in HbA1c and Fasting Serum Glucose Levelsの項に、定期的な運動、健康的な体重の維持、健康的な食事を含むライフスタイル
の最適化を追記する。
⑥Adverse Reactionsの項に、免疫介在性壊死性ミオパチー、肝機能障害、蛋白尿と血尿を追記する。
⑦Adverse ReactionsのPostmarketing Experienceの項に、眼筋無力症を含む重症筋無力症の新規発症または増悪がまれに報告されており、同じスタチンまたは別のスタ
チンを投与した場合に再発したとの報告もある旨を追記する。
⑧Adverse ReactionsのPostmarketing Experienceの項に、好酸球増加と全身症状を伴う薬物反応(DRESS)、苔癬様薬疹を追記する。
アメリカ
⑨Drug Interactionsの項に、ロスバスタチンはCYP2C9およびトランスポーター(OATP1B1、BCRPなど)の基質である。CYP2C9およびトランスポーターの阻害剤との併用に
より、ロスバスタチンの血漿中濃度が有意に上昇する可能性がある旨を追記する。
⑩Drug Interactionsの項に、併用によりロスバスタチンの効果を減少させる薬剤について、水酸化マグネシウム・水酸化アルミニウム、その他の薬剤としてワルファリンを追
記する。
⑪Pediatric Useの項に、8歳未満のHeFHの小児患者、7歳未満のHoFHの小児患者、または他のタイプの高脂血症(HeFHまたはHoFH以外)の小児患者におけるロスバ
スタチンの安全性および有効性は確立されていない旨を追記する。
⑫Geriatric Useの項に、高齢者(65歳以上)はミオパチーのリスク因子である旨を追記する。
⑬Renal Impairmentの項に、腎機能障害はミオパチーと横紋筋融解症のリスクである旨を追記する。
⑭Hepatic Impairmentの項に、ロスバスタチンは急性肝不全あるいは代償性肝硬変患者では禁忌である旨を追記する。
⑮Pregnancyの項に、妊娠が確認された場合は、ロスバスタチンを中止してください。あるいは、個々の患者における治療の継続の必要性を考慮する旨を追記する。
⑯Lactationの項に、作用機序に基づき、授乳中の乳児に重篤な有害事象が発現する可能性があるため、ロスバスタチンの治療中は授乳が推奨されないことを患者に助
言する旨を追記する。
48
アミトリプチリン塩酸塩
加HCは、許容限度値を超えるN-nitroso-nortriptyline(NNORT)が検出されたため、Apotex社のアミトリプチリン10mg錠/25mg錠の特定ロットがリコールされたことを公表し
カナダ
た。
回収
対応不要
49
アシクロビル
カナダにおいて、許容レベルを超えるnitrosamine不純物(NDMA)のため、Apo-Acyclovir錠200mg/400mg/800mgの特定ロットを回収している。
回収
対応不要
50
アミトリプチリン塩酸塩
シンガポール HSAは、許容限度値を超えるN-nitroso-nortriptyline(NNORT)が検出されたため、Pharmaforte Singapore社のアミトリプチリン10mg錠の特定ロットがリコール
シンガポール
されたことを公表した。
回収
対応不要
51
アシクロビル
シンガポールにおいて、許容レベルを超えるnitrosamine不純物(NDMA)のため、Apo-Acyclovir錠200mg/400mg/800mgの特定ロットを回収している。
シンガポール
回収
対応不要
53
トロピカミド・フェニレフリン塩
酸塩
米国FDAは、無菌性保証欠如のためCentral Admixture Pharmacy Services社のフェニレフリン/塩化ナトリウム含有バッグ、シリンジ製剤について、クラスⅡの自主回収を
実施していると公表した。
アメリカ
回収
対応不要
トラスツズマブ(遺伝子組換
え)
【第1報】
添付文書の同梱が欠落している可能性についてEUでDirect healthcare professional communicationが発出された。
【第2報】
添付文書の同梱が欠落している可能性についてスウェーデンでDirect healthcare professional communicationが発出された。
欧州連合、
スウェーデン
情報提供
対応不要
カナダ
添付文書改
訂(警告・禁
忌)
対応不要
アメリカ
添付文書改
訂(警告・禁
忌)
対応済
59
65
71
塩化カリウム含有一般用医薬
品
カナダにおいて、アミノ酸・電解質・ブドウ糖・脂質を含有する静脈内投与製剤の添付文書が改訂された。
塩化ナトリウム含有一般用医 ・Contraindicationsの項に、卵、大豆製品、落花生製品、オリーブ製品、有効成分、賦形剤に対する過敏症のある患者が追記。
薬品
クラリスロマイシン
ラベプラゾールナトリウム・アモ
クラリスロマイシン含有製剤の米国添付文書が改訂され、ContraindicationsのSerious Drug Interactionsの項に、ルラシドンが追記された。
キシシリン水和物・クラリスロマ
イシン
カナダ
添付文書改
訂(警告・禁
忌)
対応中
76
アシクロビル
【第1報、第2報、第3報】シンガポールにおいて、Apotex Inc.のアシクロビル錠(力価400mg、800mg)の特定ロットについて、許容レベルを超えるニトロソアミン不純物が含ま
シンガポール
れるとして回収されている。
回収
対応不要
82
モンテルカストナトリウム
カナダにおいて、モンテルカストナトリウム製剤から基準値を超える不純物が検出されたため製品回収がされたもの。
カナダ
回収
対応不要
85
リファンピシン
米国添付文書が改訂され、Contraindications、Drug interactions の項に併用禁忌としてルラシドンが追記された。
アメリカ
添付文書改
訂(警告・禁
忌)
対応済
2
21