よむ、つかう、まなぶ。
【資料4】医薬局からの定期報告[2.0MB] (35 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
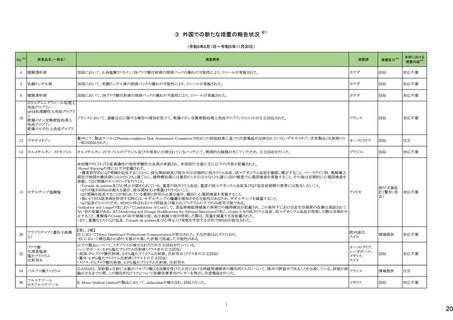
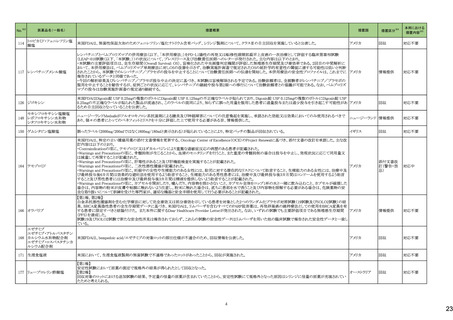
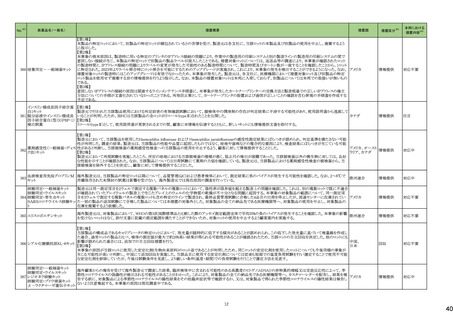
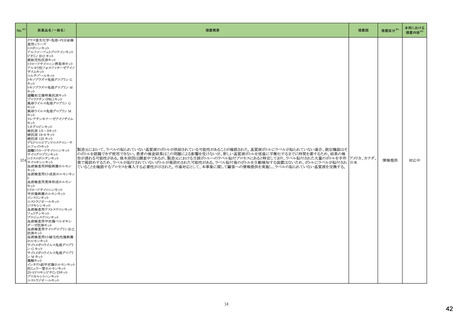
No.※3
医薬品名(一般名)
措置概要
措置国
措置区分※4
本邦における
措置内容※5
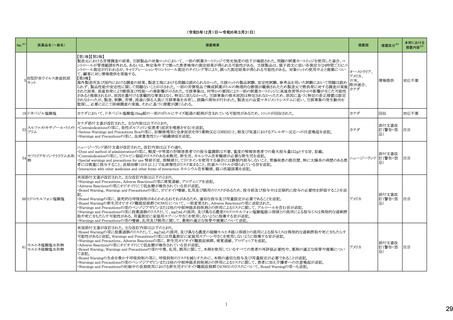
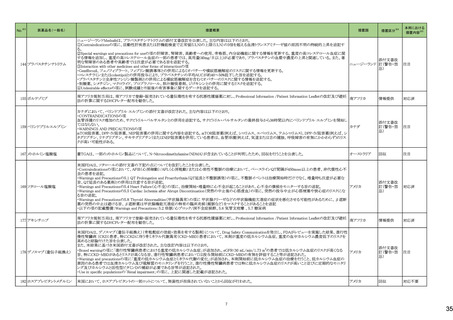
144 プラバスタチンナトリウム
ニュージーランドMedsafeは、プラバスタチンナトリウムの添付文書改訂を公表した。主な内容は以下のとおり。
①Contraindicationsの項に、活動性肝疾患または肝機能検査で正常値(ULN)の上限(ULN)の3倍を超える血清トランスアミナーゼ値の原因不明の持続的上昇を追記す
る。
②Special warnings and precautions for useの項の肝障害、腎障害、高齢者への使用、骨格筋、内分泌機能に関する情報を更新する。重度の高コレステロール血症に関
する情報を追加し、重度の高コレステロール血症の一部の患者では、高用量(40mg/日以上)が必要であり、プラバスタチンの血漿中濃度の上昇と関連している。また、著
明な腎障害のある患者や高齢者では注意が必要である旨を追記する。
③Interaction with other medicines and other forms of interactionの項
・Gemfibrozil、フェノフィブラート、フィブリン酸誘導体との併用によるミオパチーや横紋筋融解症のリスクに関する情報を更新する。
・コレスチラミンまたはcolestipolとの併用投与により、プラバスタチンの平均AUCが約40~50%低下した旨を追記する。
・プラバスタチンと全身性フシジン酸製剤との併用による横紋筋融解症を含むミオパチーのリスクに関する情報を追記する。
・制酸薬、シメチジン、マクロライド、プロプラノロール、胆汁酸吸着剤、ジゴキシンとの併用に関するリスクを追記する。
④Undesirable effectsの項に、試験成績と市販後の有害事象に関するデータを追記する。
155 ボルテゾミブ
南アフリカ規制当局は、南アフリカで登録・販売されている遺伝毒性を有する抗悪性腫瘍薬に対し、Professional Information /Patient Information Leafletの改訂及び避妊
南アフリカ
法の計算に関するDHCPレター配布を勧告した。
情報提供
対応済
159 ペリンドプリルエルブミン
カナダにおいて、ペリンドプリル エルブミンの添付文書が改訂された。主な内容は以下のとおり。
・CONTRAINDICATIONSの項
血管浮腫のリスク増加のため、サクビトリル・バルサルタンとの併用を追記する。サクビトリル・バルサルタンの最終投与から36時間以内にペリンドプリル エルブミンを開始し
てはならない。
カナダ
・WARNINGS AND PRECAUTIONSの項
mTOR阻害薬、DPP-IV阻害薬、NEP阻害薬の併用に関する内容を追記する。mTOR阻害薬(例えば、シロリムス、エベロリムス、テムシロリムス)、DPP-IV阻害薬(例えば、シ
タグリプチン、リナグリプチン、サキサグリプチン)またはNEP阻害薬を併用している患者は、血管浮腫(例えば、気道または舌の腫脹、呼吸障害の有無にかかわらず)のリス
クが高い可能性がある。
添付文書改
訂(警告・禁
忌)
注目
167 メトホルミン塩酸塩
豪TGAは、一部のメトホルミン製品について、N-Nitrosodimethylamine(NDMA)が含まれていることが判明したため、回収を行うことを公表した。
回収
注目
169 ソタロール塩酸塩
米国FDAは、ソタロールの添付文書の下記の点についてを改訂したことを公表した。
・Contraindicationsの項において、AFIB(心房細動)/AFL(心房粗動)または心室性不整脈の治療において、ベースラインQT間隔が450msec以上の患者、非代償性心不
全の患者を追記。
・Warnings and Precautionsの5.1 QT Prolongation and Proarrhythmia(QT延長と不整脈誘発)の項に、不整脈イベントは治療開始時だけでなく、増量時も注意が必要な
旨、QT延長のある薬剤との併用は注意する旨が追記。
・Warnings and Precautionsの5.4 Heart Failure(心不全)の項に、治療開始・増量時に心不全が起こることがあり、心不全の徴候をモニターする旨の追記。
アメリカ
・Warnings and Precautionsの5.5 Cardiac Ischemia after Abrupt Discontinuation(突然の中止後の心筋虚血)の項に、突然の投与中止が心筋梗塞や狭心症のリスクにな
る旨の追記。
・Warnings and Precautionsの5.8 Thyroid Abnormalities(甲状腺異常)の項に 甲状腺クリーゼなどの甲状腺機能亢進症の症状を悪化させる可能性があるために、β遮断
薬の突然の中止は避ける旨、β遮断薬は甲状腺機能亢進症の特有の臨床兆候(頻脈など)をマスクすることがあることを追記
・以下の項の記載整備:Warnings and Precautions:5.2 徐脈/心ブロック/洞不全症候群、5.6 気管支痙攣 、5.7 糖尿病
添付文書改
訂(警告・禁
忌)
対応済
177 アキシチニブ
南アフリカ規制当局は、南アフリカで登録・販売されている遺伝毒性を有する抗悪性腫瘍薬に対し、Professional Information /Patient Information Leafletの改訂及び避妊
南アフリカ
法の計算に関するDHCPレター配布を勧告した。
情報提供
対応済
178 デノスマブ(遺伝子組換え)
米国FDAは、デノスマブ(遺伝子組換え)(骨粗鬆症の効能・効果を有する製剤)について、Drug Safety Communicationを発出し、FDAがレビューを実施した結果、進行性
慢性腎臓病 (CKD)患者、特にCKDに伴う骨ミネラル代謝異常(CKD-MBD)患者において、本剤が重度の低カルシウム血症、重度の血中カルシウム濃度低下のリスクを
高めると結論付けた旨を公表した。
また、本結果に基づき米国添付文書が改訂された。主な改訂内容は以下のとおり。
・Boxed warningの項に「進行性腎臓病患者における重度の低カルシウム血症」が追加され、eGFR<30 mL/min/1.73 m2の患者では低カルシウム血症のリスクが高くなる
アメリカ
旨、特にCKD-MBDがあるとリスクが高くなる旨、進行性腎臓病患者においては投与開始前にCKD-MBDの有無を評価すること等が追記された。
・Warnings and precautionsの項に「重度の低カルシウム血症とミネラル代謝の変化」が追加され、本剤開始前に低カルシウム血症の治療を行うこと、低カルシウム血症の
素因のある患者では血清カルシウム及び電解質のモニタリングを行うこと、進行性慢性腎臓病患者では特に低カルシウム血症のリスクが高いこと並びに定期的なモニタリ
ング及びカルシウムと活性型ビタミンDの補給が必要である旨等が追記された。
・Use in specific populationsの「Renal impairment」の項に、上記に関連した記載が追記された。
添付文書改
訂(警告・禁
忌)
注目
182 ホスアプレピタントメグルミン
米国において、ホスアプレピタントの一部ロットについて、無菌性が担保されていないことから回収が行われた。
回収
対応不要
7
添付文書改
ニュージーランド 訂(警告・禁
忌)
オーストラリア
アメリカ
注目
35
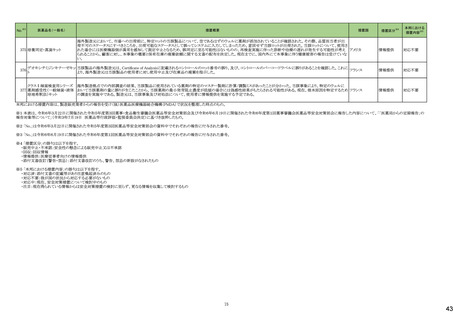
医薬品名(一般名)
措置概要
措置国
措置区分※4
本邦における
措置内容※5
144 プラバスタチンナトリウム
ニュージーランドMedsafeは、プラバスタチンナトリウムの添付文書改訂を公表した。主な内容は以下のとおり。
①Contraindicationsの項に、活動性肝疾患または肝機能検査で正常値(ULN)の上限(ULN)の3倍を超える血清トランスアミナーゼ値の原因不明の持続的上昇を追記す
る。
②Special warnings and precautions for useの項の肝障害、腎障害、高齢者への使用、骨格筋、内分泌機能に関する情報を更新する。重度の高コレステロール血症に関
する情報を追加し、重度の高コレステロール血症の一部の患者では、高用量(40mg/日以上)が必要であり、プラバスタチンの血漿中濃度の上昇と関連している。また、著
明な腎障害のある患者や高齢者では注意が必要である旨を追記する。
③Interaction with other medicines and other forms of interactionの項
・Gemfibrozil、フェノフィブラート、フィブリン酸誘導体との併用によるミオパチーや横紋筋融解症のリスクに関する情報を更新する。
・コレスチラミンまたはcolestipolとの併用投与により、プラバスタチンの平均AUCが約40~50%低下した旨を追記する。
・プラバスタチンと全身性フシジン酸製剤との併用による横紋筋融解症を含むミオパチーのリスクに関する情報を追記する。
・制酸薬、シメチジン、マクロライド、プロプラノロール、胆汁酸吸着剤、ジゴキシンとの併用に関するリスクを追記する。
④Undesirable effectsの項に、試験成績と市販後の有害事象に関するデータを追記する。
155 ボルテゾミブ
南アフリカ規制当局は、南アフリカで登録・販売されている遺伝毒性を有する抗悪性腫瘍薬に対し、Professional Information /Patient Information Leafletの改訂及び避妊
南アフリカ
法の計算に関するDHCPレター配布を勧告した。
情報提供
対応済
159 ペリンドプリルエルブミン
カナダにおいて、ペリンドプリル エルブミンの添付文書が改訂された。主な内容は以下のとおり。
・CONTRAINDICATIONSの項
血管浮腫のリスク増加のため、サクビトリル・バルサルタンとの併用を追記する。サクビトリル・バルサルタンの最終投与から36時間以内にペリンドプリル エルブミンを開始し
てはならない。
カナダ
・WARNINGS AND PRECAUTIONSの項
mTOR阻害薬、DPP-IV阻害薬、NEP阻害薬の併用に関する内容を追記する。mTOR阻害薬(例えば、シロリムス、エベロリムス、テムシロリムス)、DPP-IV阻害薬(例えば、シ
タグリプチン、リナグリプチン、サキサグリプチン)またはNEP阻害薬を併用している患者は、血管浮腫(例えば、気道または舌の腫脹、呼吸障害の有無にかかわらず)のリス
クが高い可能性がある。
添付文書改
訂(警告・禁
忌)
注目
167 メトホルミン塩酸塩
豪TGAは、一部のメトホルミン製品について、N-Nitrosodimethylamine(NDMA)が含まれていることが判明したため、回収を行うことを公表した。
回収
注目
169 ソタロール塩酸塩
米国FDAは、ソタロールの添付文書の下記の点についてを改訂したことを公表した。
・Contraindicationsの項において、AFIB(心房細動)/AFL(心房粗動)または心室性不整脈の治療において、ベースラインQT間隔が450msec以上の患者、非代償性心不
全の患者を追記。
・Warnings and Precautionsの5.1 QT Prolongation and Proarrhythmia(QT延長と不整脈誘発)の項に、不整脈イベントは治療開始時だけでなく、増量時も注意が必要な
旨、QT延長のある薬剤との併用は注意する旨が追記。
・Warnings and Precautionsの5.4 Heart Failure(心不全)の項に、治療開始・増量時に心不全が起こることがあり、心不全の徴候をモニターする旨の追記。
アメリカ
・Warnings and Precautionsの5.5 Cardiac Ischemia after Abrupt Discontinuation(突然の中止後の心筋虚血)の項に、突然の投与中止が心筋梗塞や狭心症のリスクにな
る旨の追記。
・Warnings and Precautionsの5.8 Thyroid Abnormalities(甲状腺異常)の項に 甲状腺クリーゼなどの甲状腺機能亢進症の症状を悪化させる可能性があるために、β遮断
薬の突然の中止は避ける旨、β遮断薬は甲状腺機能亢進症の特有の臨床兆候(頻脈など)をマスクすることがあることを追記
・以下の項の記載整備:Warnings and Precautions:5.2 徐脈/心ブロック/洞不全症候群、5.6 気管支痙攣 、5.7 糖尿病
添付文書改
訂(警告・禁
忌)
対応済
177 アキシチニブ
南アフリカ規制当局は、南アフリカで登録・販売されている遺伝毒性を有する抗悪性腫瘍薬に対し、Professional Information /Patient Information Leafletの改訂及び避妊
南アフリカ
法の計算に関するDHCPレター配布を勧告した。
情報提供
対応済
178 デノスマブ(遺伝子組換え)
米国FDAは、デノスマブ(遺伝子組換え)(骨粗鬆症の効能・効果を有する製剤)について、Drug Safety Communicationを発出し、FDAがレビューを実施した結果、進行性
慢性腎臓病 (CKD)患者、特にCKDに伴う骨ミネラル代謝異常(CKD-MBD)患者において、本剤が重度の低カルシウム血症、重度の血中カルシウム濃度低下のリスクを
高めると結論付けた旨を公表した。
また、本結果に基づき米国添付文書が改訂された。主な改訂内容は以下のとおり。
・Boxed warningの項に「進行性腎臓病患者における重度の低カルシウム血症」が追加され、eGFR<30 mL/min/1.73 m2の患者では低カルシウム血症のリスクが高くなる
アメリカ
旨、特にCKD-MBDがあるとリスクが高くなる旨、進行性腎臓病患者においては投与開始前にCKD-MBDの有無を評価すること等が追記された。
・Warnings and precautionsの項に「重度の低カルシウム血症とミネラル代謝の変化」が追加され、本剤開始前に低カルシウム血症の治療を行うこと、低カルシウム血症の
素因のある患者では血清カルシウム及び電解質のモニタリングを行うこと、進行性慢性腎臓病患者では特に低カルシウム血症のリスクが高いこと並びに定期的なモニタリ
ング及びカルシウムと活性型ビタミンDの補給が必要である旨等が追記された。
・Use in specific populationsの「Renal impairment」の項に、上記に関連した記載が追記された。
添付文書改
訂(警告・禁
忌)
注目
182 ホスアプレピタントメグルミン
米国において、ホスアプレピタントの一部ロットについて、無菌性が担保されていないことから回収が行われた。
回収
対応不要
7
添付文書改
ニュージーランド 訂(警告・禁
忌)
オーストラリア
アメリカ
注目
35