よむ、つかう、まなぶ。
【資料4】医薬局からの定期報告[2.0MB] (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
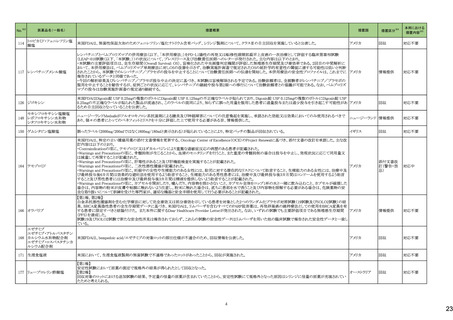
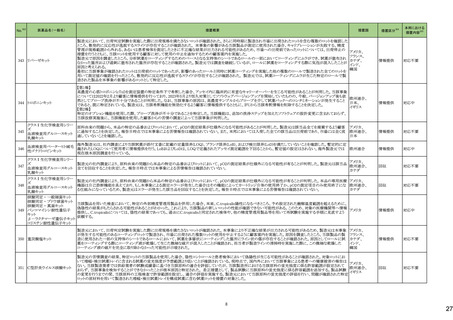
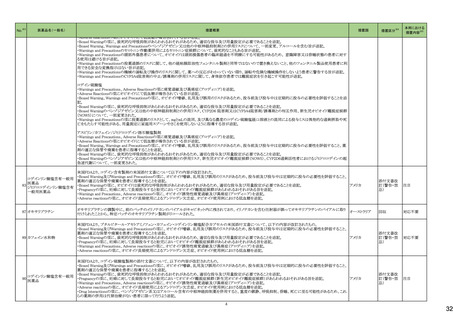
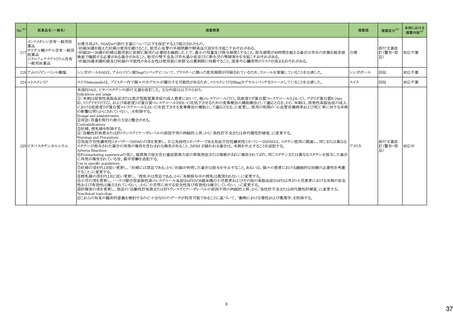
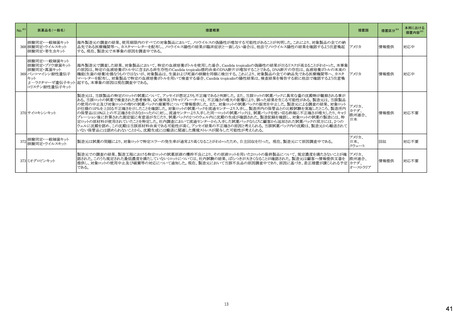
No.
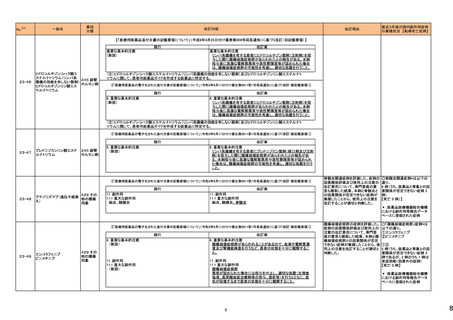
5
カテゴリー
③海外承認なし
※2
承認日
R6.3.26
販
売
名
(製造販売業者名)
アセノベル徐放錠500 mg
(ノーベルファーマ㈱)
有効成分名
アセノイラミン酸
効能・効果等
海外での使用実績
※審査報告書から抜粋
承認条件
医薬品リスク管理計画(主なもの)
1. 医薬品リスク管理計画を策定の上、適切に実施すること。
縁取り空胞を伴う遠位型ミオパチーにおける
2. 国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に
筋力低下の進行抑制を効能・効果とする新有 海外では、2023 年 12 月時点において、本
係るデータが集積されるまでの間は、全症例を対象に使用成績調査を実施すること 未公表
効成分含有医薬品
剤が承認されている国又は地域はない。
により、本剤の使用患者の背景情報を把握するとともに、本剤の安全性及び有効性
【希少疾病用医薬品】
に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
※1 本表は「「医薬局からの定期報告」の報告対象等について」(令和3年7月19日 医薬品等行政評価・監視委員会決定、令和6年4月1日最終改訂)に基づき、以下のいずれかに該当するものを抜粋したもの。
新有効成分を含有する医薬品のうち、
①先駆け審査指定制度の対象品目
②条件付き早期承認制度の対象品目
③海外で承認されていない医薬品
④特例承認の対象品目
⑤緊急承認の対象品目
(海外での承認の有無及び使用実績は、審査報告書の記載により判断しています。)
※2
「カテゴリー」の語句は以下を指す。
①先駆け:先駆け審査指定制度の対象品目
②条件付き:条件付き早期承認制度の対象品目
③海外承認なし:海外で承認されていない医薬品
④特例承認:特例承認の対象品目
⑤緊急承認:緊急承認の対象品目
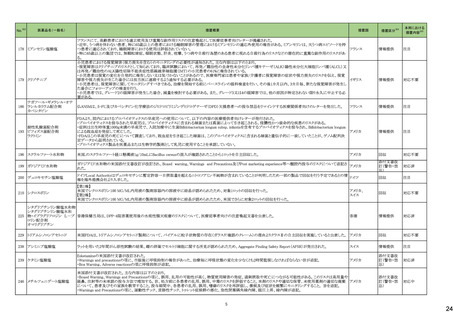
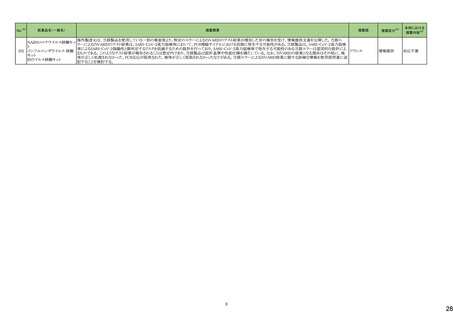
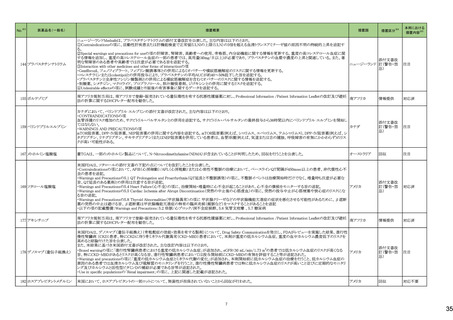
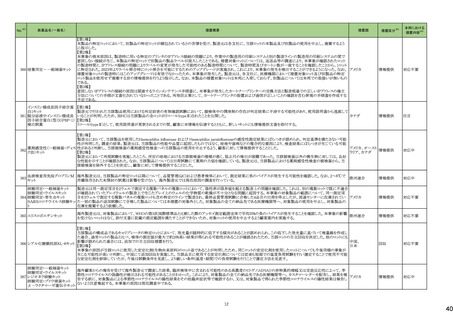
3
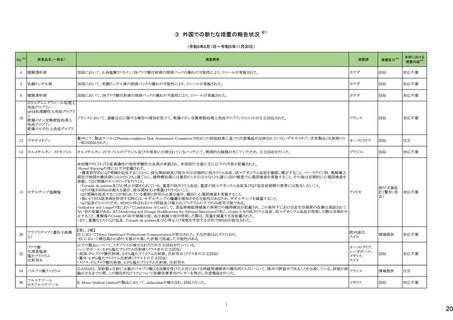
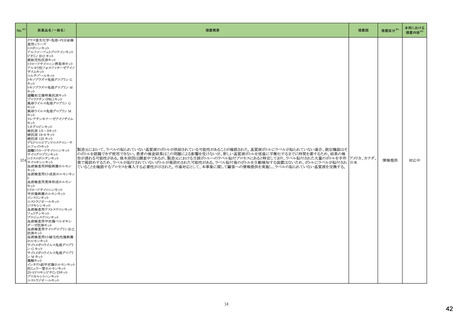
5
カテゴリー
③海外承認なし
※2
承認日
R6.3.26
販
売
名
(製造販売業者名)
アセノベル徐放錠500 mg
(ノーベルファーマ㈱)
有効成分名
アセノイラミン酸
効能・効果等
海外での使用実績
※審査報告書から抜粋
承認条件
医薬品リスク管理計画(主なもの)
1. 医薬品リスク管理計画を策定の上、適切に実施すること。
縁取り空胞を伴う遠位型ミオパチーにおける
2. 国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に
筋力低下の進行抑制を効能・効果とする新有 海外では、2023 年 12 月時点において、本
係るデータが集積されるまでの間は、全症例を対象に使用成績調査を実施すること 未公表
効成分含有医薬品
剤が承認されている国又は地域はない。
により、本剤の使用患者の背景情報を把握するとともに、本剤の安全性及び有効性
【希少疾病用医薬品】
に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
※1 本表は「「医薬局からの定期報告」の報告対象等について」(令和3年7月19日 医薬品等行政評価・監視委員会決定、令和6年4月1日最終改訂)に基づき、以下のいずれかに該当するものを抜粋したもの。
新有効成分を含有する医薬品のうち、
①先駆け審査指定制度の対象品目
②条件付き早期承認制度の対象品目
③海外で承認されていない医薬品
④特例承認の対象品目
⑤緊急承認の対象品目
(海外での承認の有無及び使用実績は、審査報告書の記載により判断しています。)
※2
「カテゴリー」の語句は以下を指す。
①先駆け:先駆け審査指定制度の対象品目
②条件付き:条件付き早期承認制度の対象品目
③海外承認なし:海外で承認されていない医薬品
④特例承認:特例承認の対象品目
⑤緊急承認:緊急承認の対象品目
3