よむ、つかう、まなぶ。
【資料4】医薬局からの定期報告[2.0MB] (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
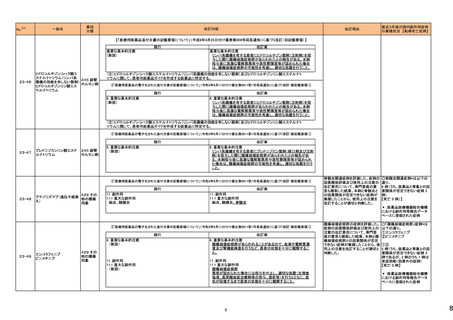
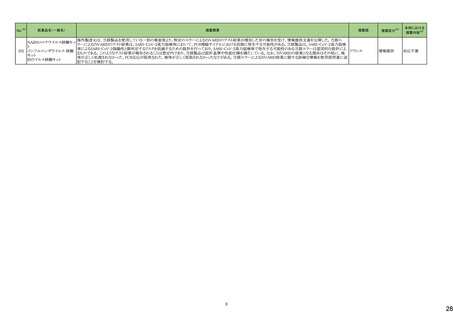
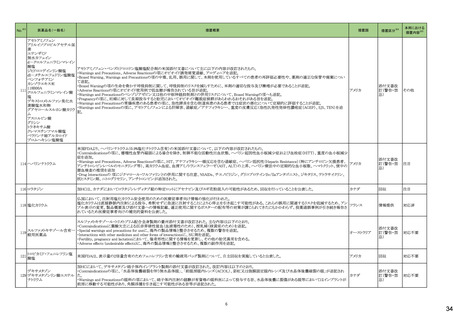
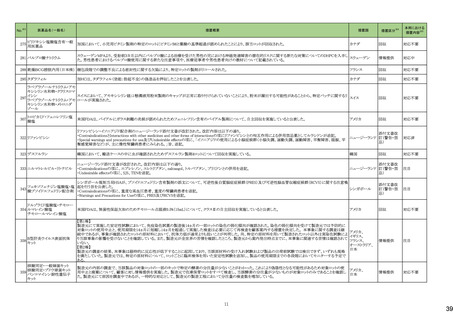
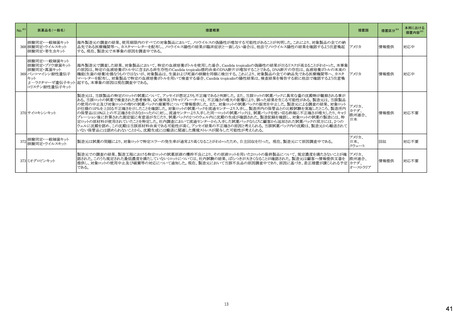
No.※2
一般名
24-14 ポサコナゾール
24-15 ボリコナゾール
薬効
分類
617 主と
してカビに
作用するも
の
617 主と
してカビに
作用するも
の
改訂内容
改訂理由
直近3年度の国内副作用症例
の集積状況 【転帰死亡症例】
24-12と同じ
―
24-12と同じ
―
現行
改訂案
2. 禁忌(次の患者には投与しないこと)
2. 禁忌(次の患者には投与しないこと)
エルゴタミン酒石酸塩・無水カフェイン・イソプロピルアンチピリン、
エルゴタミン酒石酸塩・無水カフェイン・イソプロピルアンチピリン、
ジヒドロエルゴタミン、メチルエルゴメトリン、エルゴメトリン、シンバ ジヒドロエルゴタミン、メチルエルゴメトリン、エルゴメトリン、シンバ
スタチン、アトルバスタチン、ピモジド、キニジン、ベネトクラクス[再 スタチン、アトルバスタチン、ピモジド、キニジン、ベネトクラクス
発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含 [再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫
む)の用量漸増期]、スボレキサント、ルラシドン塩酸塩、ブロナン
を含む)の用量漸増期]、スボレキサント、フィネレノン、ルラシドン
セリン、トリアゾラム、リバーロキサバンを投与中の患者
塩酸塩、ブロナンセリン、トリアゾラム、リバーロキサバンを投与中
の患者
10. 相互作用
10. 相互作用
10.1 併用禁忌(併用しないこと)
10.1 併用禁忌(併用しないこと)
薬剤名等
臨床症状・措置方法
機序・危険因子
(新設)
フィネレノン
フィネレノンの作用を ポサコナゾールの併
増強させるおそれが 用により、CYP3A4
ある。
が阻害され、これら
の薬剤の血漿中濃
度が上昇すると予
測される。
現行
改訂案
2. 禁忌(次の患者には投与しないこと)
2. 禁忌(次の患者には投与しないこと)
次の薬剤を投与中の患者:リファンピシン、リファブチン、エファビレ 次の薬剤を投与中の患者:リファンピシン、リファブチン、エファビ
ンツ、リトナビル、ロピナビル・リトナビル、ニルマトレルビル・リトナ
レンツ、リトナビル、ロピナビル・リトナビル、ニルマトレルビル・リト
ビル、カルバマゼピン、バルビタール、フェノバルビタール、ピモジ
ナビル、カルバマゼピン、バルビタール、フェノバルビタール、ピモ
ド、キニジン、イバブラジン、麦角アルカロイド(エルゴタミン・無水カ ジド、キニジン、イバブラジン、麦角アルカロイド(エルゴタミン・無
フェイン・イソプロピルアンチピリン、ジヒドロエルゴタミン、エルゴメ 水カフェイン・イソプロピルアンチピリン、ジヒドロエルゴタミン、エ
トリン、メチルエルゴメトリン)、トリアゾラム、チカグレロル、アスナ
ルゴメトリン、メチルエルゴメトリン)、トリアゾラム、チカグレロル、
プレビル、ロミタピド、ブロナンセリン、スボレキサント、リバーロキ
アスナプレビル、ロミタピド、ブロナンセリン、スボレキサント、リ
サバン、リオシグアト、アゼルニジピン、オルメサルタン メドキソミ
バーロキサバン、リオシグアト、アゼルニジピン、オルメサルタン
ル・アゼルニジピン、ベネトクラクス(再発又は難治性の慢性リンパ メドキソミル・アゼルニジピン、ベネトクラクス(再発又は難治性の
性白血病(小リンパ球性リンパ腫を含む)の用量漸増期)、アナモ
慢性リンパ性白血病(小リンパ球性リンパ腫を含む)の用量漸増
レリン、ルラシドン、イサブコナゾニウム
期)、アナモレリン、ルラシドン、イサブコナゾニウム、フィネレノン
10. 相互作用
10.1 併用禁忌(併用しないこと)
(新設)
10. 相互作用
10.1 併用禁忌(併用しないこと)
薬剤名等
臨床症状・措置方法
機序・危険因子
フィネレノン
本剤との併用により、 本剤はフィネレノン
フィネレノンの血中濃 の代謝酵素
度が上昇し、作用が (CYP3A4)を阻害す
増強するおそれがあ る。
る。
※1 本表は、令和6年 3 月 22 日の薬事・食品衛生審議会医薬品等安全対策部会、及び令和6年6月19日の薬事審議会医薬品等安全対策部会に報告した内容について、「「医薬局からの定期報告」の報告対象等について」(令和3年7月 19 日 医薬品
等行政評価・監視委員会決定)に基づき必要な追記等を行っ たもの。
※2 「No.」は安全対策部会の資料中で付与されている番号。
9
19
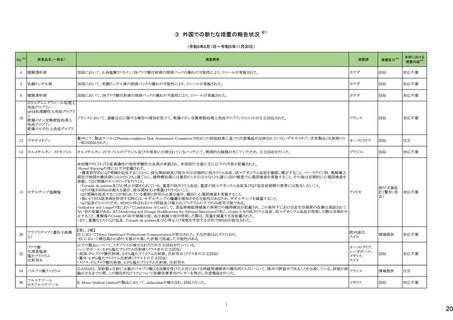
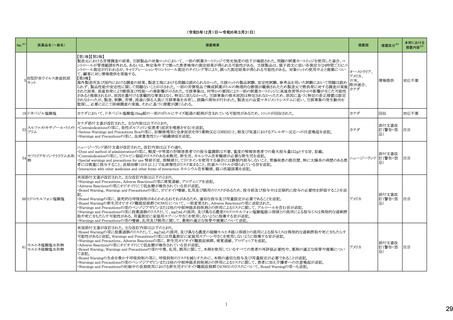
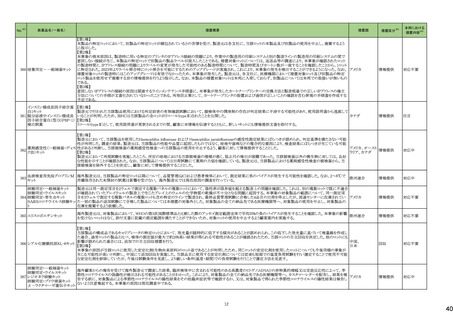
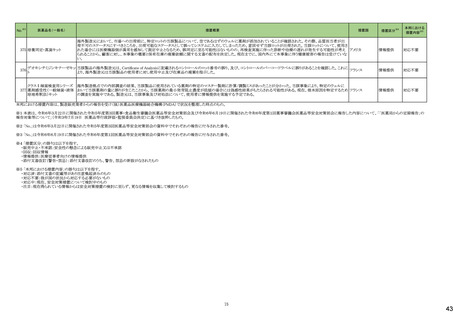
一般名
24-14 ポサコナゾール
24-15 ボリコナゾール
薬効
分類
617 主と
してカビに
作用するも
の
617 主と
してカビに
作用するも
の
改訂内容
改訂理由
直近3年度の国内副作用症例
の集積状況 【転帰死亡症例】
24-12と同じ
―
24-12と同じ
―
現行
改訂案
2. 禁忌(次の患者には投与しないこと)
2. 禁忌(次の患者には投与しないこと)
エルゴタミン酒石酸塩・無水カフェイン・イソプロピルアンチピリン、
エルゴタミン酒石酸塩・無水カフェイン・イソプロピルアンチピリン、
ジヒドロエルゴタミン、メチルエルゴメトリン、エルゴメトリン、シンバ ジヒドロエルゴタミン、メチルエルゴメトリン、エルゴメトリン、シンバ
スタチン、アトルバスタチン、ピモジド、キニジン、ベネトクラクス[再 スタチン、アトルバスタチン、ピモジド、キニジン、ベネトクラクス
発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含 [再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫
む)の用量漸増期]、スボレキサント、ルラシドン塩酸塩、ブロナン
を含む)の用量漸増期]、スボレキサント、フィネレノン、ルラシドン
セリン、トリアゾラム、リバーロキサバンを投与中の患者
塩酸塩、ブロナンセリン、トリアゾラム、リバーロキサバンを投与中
の患者
10. 相互作用
10. 相互作用
10.1 併用禁忌(併用しないこと)
10.1 併用禁忌(併用しないこと)
薬剤名等
臨床症状・措置方法
機序・危険因子
(新設)
フィネレノン
フィネレノンの作用を ポサコナゾールの併
増強させるおそれが 用により、CYP3A4
ある。
が阻害され、これら
の薬剤の血漿中濃
度が上昇すると予
測される。
現行
改訂案
2. 禁忌(次の患者には投与しないこと)
2. 禁忌(次の患者には投与しないこと)
次の薬剤を投与中の患者:リファンピシン、リファブチン、エファビレ 次の薬剤を投与中の患者:リファンピシン、リファブチン、エファビ
ンツ、リトナビル、ロピナビル・リトナビル、ニルマトレルビル・リトナ
レンツ、リトナビル、ロピナビル・リトナビル、ニルマトレルビル・リト
ビル、カルバマゼピン、バルビタール、フェノバルビタール、ピモジ
ナビル、カルバマゼピン、バルビタール、フェノバルビタール、ピモ
ド、キニジン、イバブラジン、麦角アルカロイド(エルゴタミン・無水カ ジド、キニジン、イバブラジン、麦角アルカロイド(エルゴタミン・無
フェイン・イソプロピルアンチピリン、ジヒドロエルゴタミン、エルゴメ 水カフェイン・イソプロピルアンチピリン、ジヒドロエルゴタミン、エ
トリン、メチルエルゴメトリン)、トリアゾラム、チカグレロル、アスナ
ルゴメトリン、メチルエルゴメトリン)、トリアゾラム、チカグレロル、
プレビル、ロミタピド、ブロナンセリン、スボレキサント、リバーロキ
アスナプレビル、ロミタピド、ブロナンセリン、スボレキサント、リ
サバン、リオシグアト、アゼルニジピン、オルメサルタン メドキソミ
バーロキサバン、リオシグアト、アゼルニジピン、オルメサルタン
ル・アゼルニジピン、ベネトクラクス(再発又は難治性の慢性リンパ メドキソミル・アゼルニジピン、ベネトクラクス(再発又は難治性の
性白血病(小リンパ球性リンパ腫を含む)の用量漸増期)、アナモ
慢性リンパ性白血病(小リンパ球性リンパ腫を含む)の用量漸増
レリン、ルラシドン、イサブコナゾニウム
期)、アナモレリン、ルラシドン、イサブコナゾニウム、フィネレノン
10. 相互作用
10.1 併用禁忌(併用しないこと)
(新設)
10. 相互作用
10.1 併用禁忌(併用しないこと)
薬剤名等
臨床症状・措置方法
機序・危険因子
フィネレノン
本剤との併用により、 本剤はフィネレノン
フィネレノンの血中濃 の代謝酵素
度が上昇し、作用が (CYP3A4)を阻害す
増強するおそれがあ る。
る。
※1 本表は、令和6年 3 月 22 日の薬事・食品衛生審議会医薬品等安全対策部会、及び令和6年6月19日の薬事審議会医薬品等安全対策部会に報告した内容について、「「医薬局からの定期報告」の報告対象等について」(令和3年7月 19 日 医薬品
等行政評価・監視委員会決定)に基づき必要な追記等を行っ たもの。
※2 「No.」は安全対策部会の資料中で付与されている番号。
9
19