よむ、つかう、まなぶ。
【資料4】医薬局からの定期報告[2.0MB] (36 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
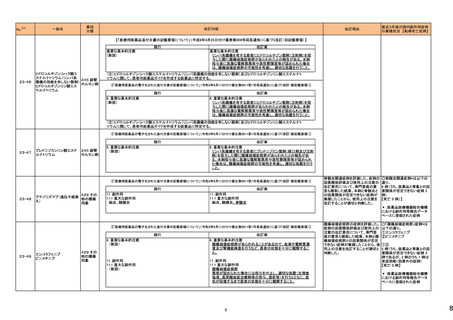
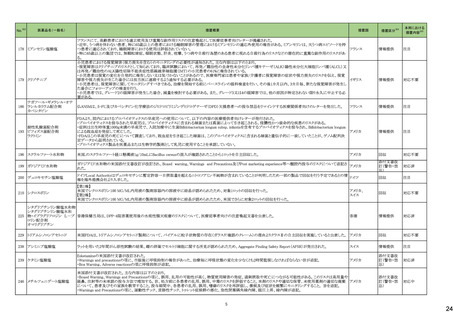
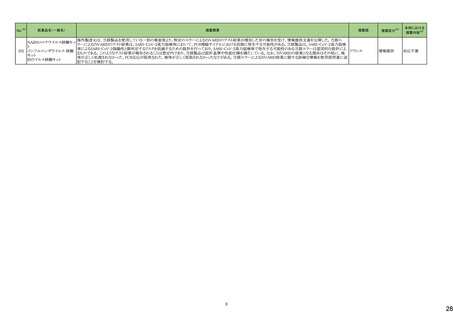
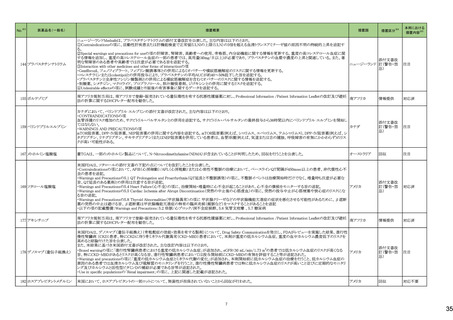
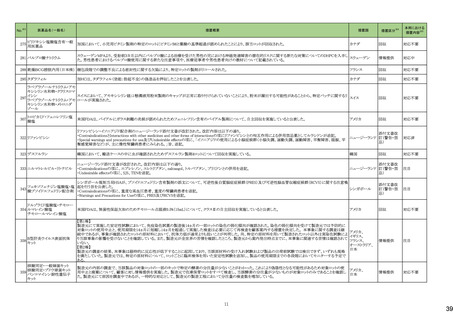
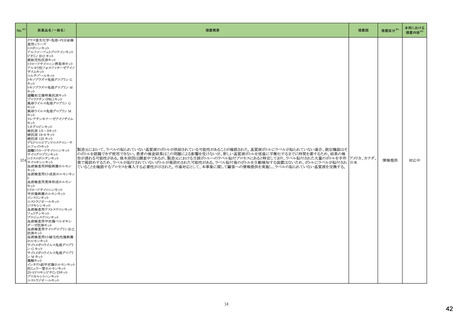
No.※3
医薬品名(一般名)
措置概要
措置国
欧州において、PRACよりプソイドエフェドリン含有製剤の添文について、可逆性後白質脳症症候群(PRES)及び可逆性脳血管収縮症候群(RCVS)に関する以下の注意
喚起を行うよう勧告され、CHMPが承認したもの。今後DHPCレターが発出される予定。
プソイドエフェドリン含有一般 ・Contraindicationsの項に、重度又はコントロール不能(治療を受けていない、又は治療に耐性がある)な高血圧患者、重度の腎臓病患者(重度の急性又は慢性腎臓病、 日本、
183
用医薬品
腎不全)を追記。
欧州連合
・Warnings and Precautions for Useの項に、PRES及びRCVSを追加し、突然の気分不良、嘔吐、混乱、発作、視力の変化を伴う激しい頭痛等の症状があらわれた場合に
はただちに投与中止し医師に相談するよう追記。
191
添付文書改
訂(警告・禁
忌)
本邦における
措置内容※5
注目
【第1報】
豪州添付文書が改訂された。改訂内容は以下の通り。
・Contraindicationsにリルピビリン(持効性懸濁注射液)との併用を追記。
・Special warnings and precautions for useにエルビテグラビル、ソホスブビルを含む抗HCV薬との併用について追記。
・Interactions with other medicines and other forms of interactionsにドルテグラビル、エルビテグラビル・コビシスタット、エトラビリン、ソホスブビル、ベダキリン、エチニルエ
添付文書改
ストラジオール・ノルエチステロンを追記。
オーストラリア、
訂(警告・禁
【第2報】
ニュージーランド
忌)
ニュージーランド添付文書が改訂された。改訂内容は以下の通り。
・Contraindicationsにリルピビリン(持効性懸濁注射液)との併用を追記。
・Special warnings and precautions for useにエルビテグラビル、ソホスブビルを含む抗HCV薬との併用について追記。
・Interactions with other medicines and other forms of interactionsに、atazanavir/ritonavir、darunavir/ritonavir、ドルテグラビル、エルビテグラビル・コビシスタット、エトラビ
リン、ソホスブビル、ベダキリン、エチニルエストラジオール・ノルエチステロンを追記。
対応済
アンピロキシカム
ピロキシカム
欧州において、PRACよりピロキシカム含有局所製剤の添文について以下の内容を改訂するよう勧告され、CMDhが合意したもの。
・Contraindicationsの項、経口剤等と同様に妊娠後期を禁忌とすること。また、妊娠前期及び妊娠中期では必要な場合のみ使用し、使用の際には可能な限り投与量及び オランダ
投与期間を少なくすることを追記。
対応不要
B 型肝炎ウイルス表面抗体
キット
製造元における苦情調査の結果、特定の試薬の液量不足により測定機器で吸引エラーが発生することが確認された。苦情情報により、特定の試薬において、100回用の
アメリカ、
試薬に対して約65回分の液量であった。顧客へ情報提供文書を提供し、速やかに対象ロットの使用を中止し、在庫分も含め廃棄すること等について通知した。製造元に
欧州連合、カナ
よるこれまでの調査の結果、対象ロットの製品の分注日を含む前後一定期間の製造記録より、分注工程に問題は認められていないことが確認されている。現在、製造元に
情報提供
ダ、
おいて当該不具合の原因調査中である。原因調査の結果に基づき、是正措置が講じられる予定である。他のロットの製品において、試薬ボトルの液量不足による吸引エ
オーストラリア
ラーの苦情の増加は観察されていないため、現時点において他のロットの製品に当該不良が及ぶものではないと判断し、範囲は対象ロットに特定された。
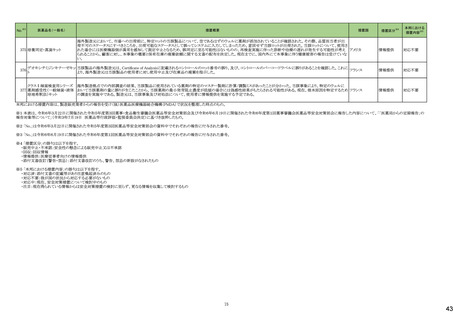
186 リファブチン
188
措置区分※4
195 ガドテリドール
ガドテリドールの米国添付文書が改訂され、Boxed Warning及びWarnings and Precautionsに髄腔内投与に関連するリスクが追記された。
アメリカ
208 ガドブトロール
ガドブトロールの米国添付文書が改訂され、Boxed Warning及びWarnings and Precautionsに髄腔内投与に関連するリスクが追記された。
アメリカ
209 ガドキセト酸ナトリウム
ガドキセト酸ナトリウムの米国添付文書が改訂され、Boxed Warning及びWarnings and Precautionsに髄腔内投与に関連するリスクが追記された。
アメリカ
212 ガドテル酸メグルミン
ガドテル酸メグルミンの米国添付文書が改訂され、Boxed Warning及びWarnings and Precautionsに髄腔内投与に関連するリスクが追記された。
アメリカ
カナダにおいて、ロスバスタチンカルシウムの添付文書が改訂された。主な内容は以下のとおり。
・Contraindications
ロスバスタチンを服用している女性には授乳は禁忌である。
・Recommended Dose and Dosage Adjustment
妊娠が確認され次第、ロスバスタチンを中止すべきである。しかし、心血管イベントのリスクが非常に高い個々の患者では、治療上の必要性とベネフィットリスクを考慮すべ
きである。
・WARNINGS AND PRECAUTIONSのReproductive Health: Female and Male Potential
コレステロールやコレステロール生合成産物は、胎児の発達(ステロイドや細胞膜の合成を含む)に不可欠な成分である。ロスバスタチンは妊婦への投与は推奨されない。
アテローム性動脈硬化症は慢性のプロセスであり、妊娠中の脂質代謝調節薬の中止は、原発性高コレステロール血症の長期治療の転帰にほとんど影響を及ぼさないは
カナダ
ずである。しかし、心血管イベントのリスクが非常に高い個々の患者における治療上の必要性とベネフィットリスクを考慮すべきである。
・WARNINGS AND PRECAUTIONSのPregnant Women
妊婦への投与は推奨されず、妊娠が確認され次第、投与を中止すること。ロスバスタチンの作用機序により、胎児に副作用、胎児に有害な影響を及ぼすおそれがある。流
産のリスクを評価するにはデータが不十分である。しかし、心血管イベントのリスクが非常に高い個々の患者では、治療上の必要性とベネフィットリスクを考慮すべきであ
る。
・WARNINGS AND PRECAUTIONSのBreast-feeding
公表された報告からのデータは、ロスバスタチンがヒト母乳中に移行することを示している。本剤の作用機序により、乳児では有害反応のリスクが潜在する。授乳中の乳児
に対する本剤の影響、母乳の脂質プロファイル、母乳産生に対する本剤の影響に関する情報は得られていない。したがって、本剤を服用している女性は授乳すべきでは
ない。リスク・ベネフィットを評価した結果、授乳中の母親に本剤を使用する場合は、授乳の代わりに調製乳を使用すべきである。
ロスバスタチンカルシウム
214 エゼチミブ・ロスバスタチンカ
ルシウム配合剤
8
添付文書改
訂(警告・禁
忌)
添付文書改
訂(警告・禁
添付文書改
訂(警告・禁
添付文書改
訂(警告・禁
添付文書改
訂(警告・禁
添付文書改
訂(警告・禁
忌)
対応不要
対応済
対応済
注目
対応済
対応中
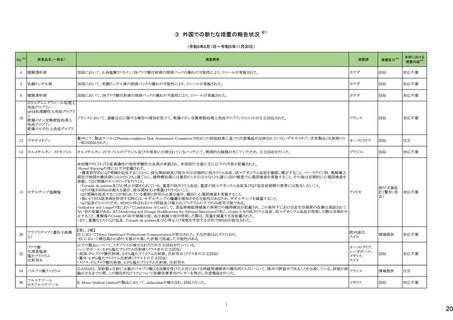
36
医薬品名(一般名)
措置概要
措置国
欧州において、PRACよりプソイドエフェドリン含有製剤の添文について、可逆性後白質脳症症候群(PRES)及び可逆性脳血管収縮症候群(RCVS)に関する以下の注意
喚起を行うよう勧告され、CHMPが承認したもの。今後DHPCレターが発出される予定。
プソイドエフェドリン含有一般 ・Contraindicationsの項に、重度又はコントロール不能(治療を受けていない、又は治療に耐性がある)な高血圧患者、重度の腎臓病患者(重度の急性又は慢性腎臓病、 日本、
183
用医薬品
腎不全)を追記。
欧州連合
・Warnings and Precautions for Useの項に、PRES及びRCVSを追加し、突然の気分不良、嘔吐、混乱、発作、視力の変化を伴う激しい頭痛等の症状があらわれた場合に
はただちに投与中止し医師に相談するよう追記。
191
添付文書改
訂(警告・禁
忌)
本邦における
措置内容※5
注目
【第1報】
豪州添付文書が改訂された。改訂内容は以下の通り。
・Contraindicationsにリルピビリン(持効性懸濁注射液)との併用を追記。
・Special warnings and precautions for useにエルビテグラビル、ソホスブビルを含む抗HCV薬との併用について追記。
・Interactions with other medicines and other forms of interactionsにドルテグラビル、エルビテグラビル・コビシスタット、エトラビリン、ソホスブビル、ベダキリン、エチニルエ
添付文書改
ストラジオール・ノルエチステロンを追記。
オーストラリア、
訂(警告・禁
【第2報】
ニュージーランド
忌)
ニュージーランド添付文書が改訂された。改訂内容は以下の通り。
・Contraindicationsにリルピビリン(持効性懸濁注射液)との併用を追記。
・Special warnings and precautions for useにエルビテグラビル、ソホスブビルを含む抗HCV薬との併用について追記。
・Interactions with other medicines and other forms of interactionsに、atazanavir/ritonavir、darunavir/ritonavir、ドルテグラビル、エルビテグラビル・コビシスタット、エトラビ
リン、ソホスブビル、ベダキリン、エチニルエストラジオール・ノルエチステロンを追記。
対応済
アンピロキシカム
ピロキシカム
欧州において、PRACよりピロキシカム含有局所製剤の添文について以下の内容を改訂するよう勧告され、CMDhが合意したもの。
・Contraindicationsの項、経口剤等と同様に妊娠後期を禁忌とすること。また、妊娠前期及び妊娠中期では必要な場合のみ使用し、使用の際には可能な限り投与量及び オランダ
投与期間を少なくすることを追記。
対応不要
B 型肝炎ウイルス表面抗体
キット
製造元における苦情調査の結果、特定の試薬の液量不足により測定機器で吸引エラーが発生することが確認された。苦情情報により、特定の試薬において、100回用の
アメリカ、
試薬に対して約65回分の液量であった。顧客へ情報提供文書を提供し、速やかに対象ロットの使用を中止し、在庫分も含め廃棄すること等について通知した。製造元に
欧州連合、カナ
よるこれまでの調査の結果、対象ロットの製品の分注日を含む前後一定期間の製造記録より、分注工程に問題は認められていないことが確認されている。現在、製造元に
情報提供
ダ、
おいて当該不具合の原因調査中である。原因調査の結果に基づき、是正措置が講じられる予定である。他のロットの製品において、試薬ボトルの液量不足による吸引エ
オーストラリア
ラーの苦情の増加は観察されていないため、現時点において他のロットの製品に当該不良が及ぶものではないと判断し、範囲は対象ロットに特定された。
186 リファブチン
188
措置区分※4
195 ガドテリドール
ガドテリドールの米国添付文書が改訂され、Boxed Warning及びWarnings and Precautionsに髄腔内投与に関連するリスクが追記された。
アメリカ
208 ガドブトロール
ガドブトロールの米国添付文書が改訂され、Boxed Warning及びWarnings and Precautionsに髄腔内投与に関連するリスクが追記された。
アメリカ
209 ガドキセト酸ナトリウム
ガドキセト酸ナトリウムの米国添付文書が改訂され、Boxed Warning及びWarnings and Precautionsに髄腔内投与に関連するリスクが追記された。
アメリカ
212 ガドテル酸メグルミン
ガドテル酸メグルミンの米国添付文書が改訂され、Boxed Warning及びWarnings and Precautionsに髄腔内投与に関連するリスクが追記された。
アメリカ
カナダにおいて、ロスバスタチンカルシウムの添付文書が改訂された。主な内容は以下のとおり。
・Contraindications
ロスバスタチンを服用している女性には授乳は禁忌である。
・Recommended Dose and Dosage Adjustment
妊娠が確認され次第、ロスバスタチンを中止すべきである。しかし、心血管イベントのリスクが非常に高い個々の患者では、治療上の必要性とベネフィットリスクを考慮すべ
きである。
・WARNINGS AND PRECAUTIONSのReproductive Health: Female and Male Potential
コレステロールやコレステロール生合成産物は、胎児の発達(ステロイドや細胞膜の合成を含む)に不可欠な成分である。ロスバスタチンは妊婦への投与は推奨されない。
アテローム性動脈硬化症は慢性のプロセスであり、妊娠中の脂質代謝調節薬の中止は、原発性高コレステロール血症の長期治療の転帰にほとんど影響を及ぼさないは
カナダ
ずである。しかし、心血管イベントのリスクが非常に高い個々の患者における治療上の必要性とベネフィットリスクを考慮すべきである。
・WARNINGS AND PRECAUTIONSのPregnant Women
妊婦への投与は推奨されず、妊娠が確認され次第、投与を中止すること。ロスバスタチンの作用機序により、胎児に副作用、胎児に有害な影響を及ぼすおそれがある。流
産のリスクを評価するにはデータが不十分である。しかし、心血管イベントのリスクが非常に高い個々の患者では、治療上の必要性とベネフィットリスクを考慮すべきであ
る。
・WARNINGS AND PRECAUTIONSのBreast-feeding
公表された報告からのデータは、ロスバスタチンがヒト母乳中に移行することを示している。本剤の作用機序により、乳児では有害反応のリスクが潜在する。授乳中の乳児
に対する本剤の影響、母乳の脂質プロファイル、母乳産生に対する本剤の影響に関する情報は得られていない。したがって、本剤を服用している女性は授乳すべきでは
ない。リスク・ベネフィットを評価した結果、授乳中の母親に本剤を使用する場合は、授乳の代わりに調製乳を使用すべきである。
ロスバスタチンカルシウム
214 エゼチミブ・ロスバスタチンカ
ルシウム配合剤
8
添付文書改
訂(警告・禁
忌)
添付文書改
訂(警告・禁
添付文書改
訂(警告・禁
添付文書改
訂(警告・禁
添付文書改
訂(警告・禁
添付文書改
訂(警告・禁
忌)
対応不要
対応済
対応済
注目
対応済
対応中
36