よむ、つかう、まなぶ。
【資料4】医薬局からの定期報告[2.0MB] (38 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
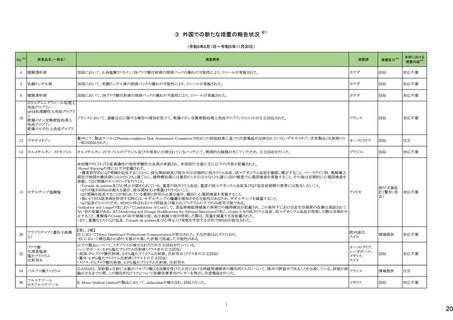
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
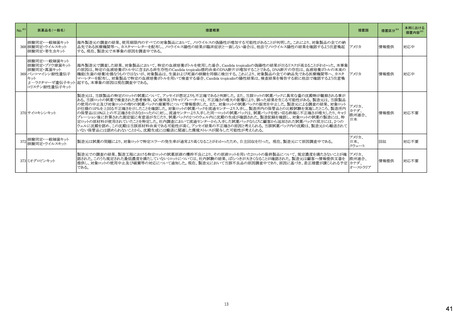
No.※3
医薬品名(一般名)
措置概要
措置国
米国FDAは、エゼチミブ・シンバスタチンの添付文書を改訂した。主な内容は以下のとおり。
Contraindications
①強いCYP3A4阻害薬との併用について、薬剤名を「イトラコナゾール、ケトコナゾール、ポサコナゾール、ボリコナゾール、HIV プロテアーゼ阻害剤、boceprevir、テラプレ
ビル、エリスロマイシン、クラリスロマイシン、テリスロマイシン、nefazodone、およびコビシスタット含有製品」から「アゾール系抗真菌薬、マクロライド系抗生物質、抗ウイルス
薬、nefazodone」に変更する。
②「活動性肝疾患または肝トランスアミナーゼレベルの原因不明の持続的上昇」から「急性肝不全または非代償性肝硬変」に変更する。
③「本剤の成分に対する過敏症」から「シンバスタチン、エゼチミブまたは本剤の賦形剤に対する過敏症。アナフィラキシー、血管浮腫及びスティーブンス・ジョンソン症候
群を含む過敏症が報告されている」に変更する。
Warnings and Precautions
④ミオパチーと横紋筋融解症の項の臨床成績、リスク因子の記載を更新する。
⑤免疫介在性壊死性ミオパチー(IMNM)の項を更新し、自己免疫性ミオパチーである免疫介在性壊死性ミオパシー(IMNM)は、スタチン使用に関連し、同じまたは異なる
スタチンが投与された場合の再発の報告を含むまれな報告があること、筋生検では重大な炎症を伴わない壊死性ミオパチーがあること、IMNM が疑われる場合は、本剤を
中止することを追記する。
⑥項目名を肝酵素から肝機能障害に変更し、血清トランスアミナーゼの増加が持続的に認められることがある。致死的および非致死的な肝不全の市販後報告がまれにあ
る等の記載を追加する。
アメリカ
⑦項目名を内分泌機能からHbA1c及び空腹時血清グルコースレベルの増加に変更し、定期的な運動、健康的な体重の維持、健康的な食事の選択など、ライフスタイル
を最適化することを追記する。
Adverse Reactions
⑧免疫介在性壊死性ミオパチー、肝機能障害、HbA1c及び空腹時血清グルコースレベルの増加を追記する。
⑨Postmarketing experienceの項に、眼筋無力症を含む重症筋無力症の新規発症または増悪がまれに報告されており、同じスタチンまたは異なるスタチンを投与した場合
に再発が報告されている旨、扁平苔癬を追記する。
Use in Specific Populations
⑩妊婦の項をPLLR従い更新し、「妊婦又は妊娠する可能性のある女性には投与しないこと」から、「妊娠が判明した場合は投与を中止すること。あるいは、個々の患者に
おける継続的な治療の必要性を考慮すること」に変更する。
⑪授乳婦の項をPLLRに従い更新し、「授乳を中止あるいは薬剤を中止する」から「本剤投与中の授乳は推奨されない」に変更する。
⑫小児の項を更新し、HeFHの10歳未満の小児患者及び他の高脂血症の小児患者における本剤の安全性及び有効性は確立していない旨を追記する。
⑬高齢者の項を更新し、高齢(65歳以上)はミオパチーと横紋筋融解症のリスク因子であること、高齢者では用量に注意すべきである等を記載する。
⑭腎障害の項を更新し、腎障害はミオパチーと横紋筋融解症のリスク因子であること、患者をモニターすること等を記載する。
⑮肝障害の項を更新し、禁忌の「活動性肝疾患または肝トランスアミナーゼレベルの原因不明の持続的上昇」を「急性肝不全または非代償性肝硬変」に変更する。
措置区分※4
本邦における
措置内容※5
添付文書改
訂(警告・禁
忌)
対応中
米国FDAより、ヘパリンナトリウム加5%ブドウ糖注射液の米国添付文書について、以下の内容が改訂されたもの。
・Contraindicationsの項に、播種性血管内凝固による場合を除き、制御不能な活動性出血状態、ヘパリン起因性血小板減少症および血栓症(HITT)、重度の血小板減少
症を追加。
・Warnings and Precautions、Adverse Reactionsの項に、HIIT、アナフィラキシー様反応を含む過敏症、ヘパリン抵抗性(Heparin Resistance)(特にアンチロビン欠損患者、 アメリカ
アンチトロンビンレベルのモニタリング等)、高カリウム血症、血清アミノトランスフェラーゼ(AST、ALT)の上昇、ヘパリン療法中の定期的な血小板数、ヘマトクリット、便中の
潜血検査の推奨を追加
・Drug Interactionsの 項に、抗ヒスタミン剤、アンチトロンビンの他、静注用ニトログリセリンが追加された。
添付文書改
訂(警告・禁
忌)
注目
アポモルヒネの豪州製品情報について、アポモルヒネと5-HT3拮抗剤の併用により重度の低血圧および意識消失のリスクがあることの報告に基づき、アポモルヒネの製品
オーストラリア
情報の禁忌及び他医薬品との相互作用の項において、制吐剤を含む5-HT3拮抗剤が併用禁忌薬として追加された。
添付文書改
訂(警告・禁
忌)
注目
251 クロミフェンクエン酸塩
クロミフェンクエン酸塩の豪州添付文書が改訂された。主な内容は以下のとおり。
CONTRAINDICATIONSに、本剤の使用に関連した医学的に確認された重大な視力障害の既往歴のある患者が追記された。
添付文書改
訂(警告・禁
忌)
注目
257 ラモトリギン
【第1報】
イスラエルの保健省は、高用量ラモトリギンで治療開始した女性患者1例に発現したDRESSの報告を受けて、ラモトリギンの全製造販売業者に対して、適正使用情報の注
意喚起のために、医療従事者向けダイレクトレター(DHCPL)を配布するように要請した。製造販売業者は、皮膚事象の意識向上を目的としてDHCPLの配布を決定した。 イスラエル
【第2報】
DHCPLが配布された。
情報提供
注目
271 クロルマジノン酢酸エステル
独BfArmは、クロルマジノン酢酸エステル/エチニルエストラジオール配合避妊薬について、Direct Healthcare Professional Communication(DHPC)を公表した。主な内容
は以下のとおり。
ドイツ
後ろ向きコホート研究RIVET-RCS1において、クロルマジノン酢酸エステル/エチニルエストラジオール含有避妊薬を服用した女性は、レボノルゲストレル/エチニルエストラ
ジオール含有避妊薬を服用した女性と比較して、静脈血栓塞栓症のリスクが1.25倍高かった。
情報提供
対応済
米国において、製造過程でのエラーによるビタミンD3含有量の高度な上昇が報告されたことにより、リキッド性ビタミンD3製剤が自主回収された。
回収
対応不要
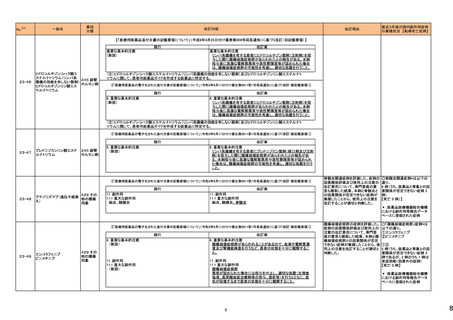
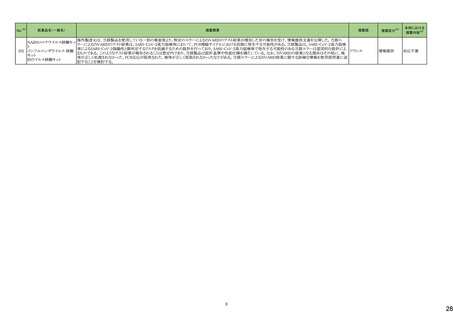
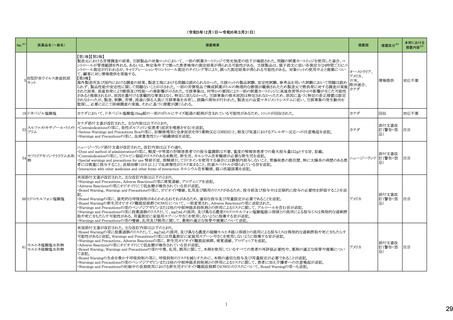
226
シンバスタチン
エゼチミブ
228 ヘパリンナトリウム
236
274
パロノセトロン塩酸塩
グラニセトロン塩酸塩
コレカルシフェロール含有一
般用医薬品
10
オーストラリア
アメリカ
38
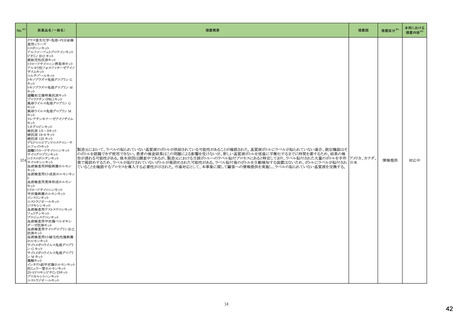
医薬品名(一般名)
措置概要
措置国
米国FDAは、エゼチミブ・シンバスタチンの添付文書を改訂した。主な内容は以下のとおり。
Contraindications
①強いCYP3A4阻害薬との併用について、薬剤名を「イトラコナゾール、ケトコナゾール、ポサコナゾール、ボリコナゾール、HIV プロテアーゼ阻害剤、boceprevir、テラプレ
ビル、エリスロマイシン、クラリスロマイシン、テリスロマイシン、nefazodone、およびコビシスタット含有製品」から「アゾール系抗真菌薬、マクロライド系抗生物質、抗ウイルス
薬、nefazodone」に変更する。
②「活動性肝疾患または肝トランスアミナーゼレベルの原因不明の持続的上昇」から「急性肝不全または非代償性肝硬変」に変更する。
③「本剤の成分に対する過敏症」から「シンバスタチン、エゼチミブまたは本剤の賦形剤に対する過敏症。アナフィラキシー、血管浮腫及びスティーブンス・ジョンソン症候
群を含む過敏症が報告されている」に変更する。
Warnings and Precautions
④ミオパチーと横紋筋融解症の項の臨床成績、リスク因子の記載を更新する。
⑤免疫介在性壊死性ミオパチー(IMNM)の項を更新し、自己免疫性ミオパチーである免疫介在性壊死性ミオパシー(IMNM)は、スタチン使用に関連し、同じまたは異なる
スタチンが投与された場合の再発の報告を含むまれな報告があること、筋生検では重大な炎症を伴わない壊死性ミオパチーがあること、IMNM が疑われる場合は、本剤を
中止することを追記する。
⑥項目名を肝酵素から肝機能障害に変更し、血清トランスアミナーゼの増加が持続的に認められることがある。致死的および非致死的な肝不全の市販後報告がまれにあ
る等の記載を追加する。
アメリカ
⑦項目名を内分泌機能からHbA1c及び空腹時血清グルコースレベルの増加に変更し、定期的な運動、健康的な体重の維持、健康的な食事の選択など、ライフスタイル
を最適化することを追記する。
Adverse Reactions
⑧免疫介在性壊死性ミオパチー、肝機能障害、HbA1c及び空腹時血清グルコースレベルの増加を追記する。
⑨Postmarketing experienceの項に、眼筋無力症を含む重症筋無力症の新規発症または増悪がまれに報告されており、同じスタチンまたは異なるスタチンを投与した場合
に再発が報告されている旨、扁平苔癬を追記する。
Use in Specific Populations
⑩妊婦の項をPLLR従い更新し、「妊婦又は妊娠する可能性のある女性には投与しないこと」から、「妊娠が判明した場合は投与を中止すること。あるいは、個々の患者に
おける継続的な治療の必要性を考慮すること」に変更する。
⑪授乳婦の項をPLLRに従い更新し、「授乳を中止あるいは薬剤を中止する」から「本剤投与中の授乳は推奨されない」に変更する。
⑫小児の項を更新し、HeFHの10歳未満の小児患者及び他の高脂血症の小児患者における本剤の安全性及び有効性は確立していない旨を追記する。
⑬高齢者の項を更新し、高齢(65歳以上)はミオパチーと横紋筋融解症のリスク因子であること、高齢者では用量に注意すべきである等を記載する。
⑭腎障害の項を更新し、腎障害はミオパチーと横紋筋融解症のリスク因子であること、患者をモニターすること等を記載する。
⑮肝障害の項を更新し、禁忌の「活動性肝疾患または肝トランスアミナーゼレベルの原因不明の持続的上昇」を「急性肝不全または非代償性肝硬変」に変更する。
措置区分※4
本邦における
措置内容※5
添付文書改
訂(警告・禁
忌)
対応中
米国FDAより、ヘパリンナトリウム加5%ブドウ糖注射液の米国添付文書について、以下の内容が改訂されたもの。
・Contraindicationsの項に、播種性血管内凝固による場合を除き、制御不能な活動性出血状態、ヘパリン起因性血小板減少症および血栓症(HITT)、重度の血小板減少
症を追加。
・Warnings and Precautions、Adverse Reactionsの項に、HIIT、アナフィラキシー様反応を含む過敏症、ヘパリン抵抗性(Heparin Resistance)(特にアンチロビン欠損患者、 アメリカ
アンチトロンビンレベルのモニタリング等)、高カリウム血症、血清アミノトランスフェラーゼ(AST、ALT)の上昇、ヘパリン療法中の定期的な血小板数、ヘマトクリット、便中の
潜血検査の推奨を追加
・Drug Interactionsの 項に、抗ヒスタミン剤、アンチトロンビンの他、静注用ニトログリセリンが追加された。
添付文書改
訂(警告・禁
忌)
注目
アポモルヒネの豪州製品情報について、アポモルヒネと5-HT3拮抗剤の併用により重度の低血圧および意識消失のリスクがあることの報告に基づき、アポモルヒネの製品
オーストラリア
情報の禁忌及び他医薬品との相互作用の項において、制吐剤を含む5-HT3拮抗剤が併用禁忌薬として追加された。
添付文書改
訂(警告・禁
忌)
注目
251 クロミフェンクエン酸塩
クロミフェンクエン酸塩の豪州添付文書が改訂された。主な内容は以下のとおり。
CONTRAINDICATIONSに、本剤の使用に関連した医学的に確認された重大な視力障害の既往歴のある患者が追記された。
添付文書改
訂(警告・禁
忌)
注目
257 ラモトリギン
【第1報】
イスラエルの保健省は、高用量ラモトリギンで治療開始した女性患者1例に発現したDRESSの報告を受けて、ラモトリギンの全製造販売業者に対して、適正使用情報の注
意喚起のために、医療従事者向けダイレクトレター(DHCPL)を配布するように要請した。製造販売業者は、皮膚事象の意識向上を目的としてDHCPLの配布を決定した。 イスラエル
【第2報】
DHCPLが配布された。
情報提供
注目
271 クロルマジノン酢酸エステル
独BfArmは、クロルマジノン酢酸エステル/エチニルエストラジオール配合避妊薬について、Direct Healthcare Professional Communication(DHPC)を公表した。主な内容
は以下のとおり。
ドイツ
後ろ向きコホート研究RIVET-RCS1において、クロルマジノン酢酸エステル/エチニルエストラジオール含有避妊薬を服用した女性は、レボノルゲストレル/エチニルエストラ
ジオール含有避妊薬を服用した女性と比較して、静脈血栓塞栓症のリスクが1.25倍高かった。
情報提供
対応済
米国において、製造過程でのエラーによるビタミンD3含有量の高度な上昇が報告されたことにより、リキッド性ビタミンD3製剤が自主回収された。
回収
対応不要
226
シンバスタチン
エゼチミブ
228 ヘパリンナトリウム
236
274
パロノセトロン塩酸塩
グラニセトロン塩酸塩
コレカルシフェロール含有一
般用医薬品
10
オーストラリア
アメリカ
38