よむ、つかう、まなぶ。
【医薬品・医療機器等安全性情報No.416】 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000185468_00019.html |
| 出典情報 | 医薬品・医療機器等安全性情報 416号(1/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
厚生労働省医薬局
416
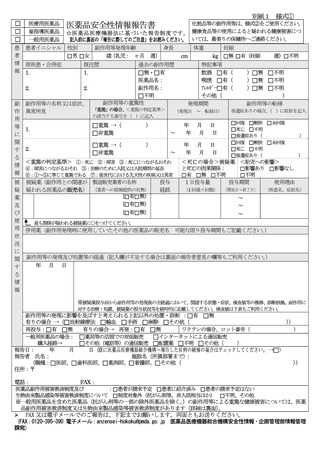
【情報の概要】
No.
医薬品等
対策
情報の概要
頁
1
新型コロナウイルス感染症に対
する経口抗ウイルス薬(ゾコー
バ錠 125mg及びラゲブリオカプ
セル 200mg)の使用上の注意の
改訂について
厚生労働省は,令和6年12月17日に「使用上の注意」の改訂指示
通知を発出し,エンシトレルビル フマル酸(ゾコーバ錠125mg)
及びモルヌピラビル(ラゲブリオカプセル200mg)の製造販売業者
に対して,妊娠する可能性のある女性への投与に際しては,投与
3
の必要性を十分に検討する旨,並びに投与が必要と判断される場
合においても投与開始前に十分な問診により妊娠していないこと及
び妊娠している可能性がないことの確認を行うこと等の注意事項
を追記するよう指示しましたので,その内容等について紹介します。
2
①イプラグリフロジン L-プロ
リン,②シタグリプチンリン酸塩
水和物・イプラグリフロジン L
-プロリン配合剤,③エンパグ
リフロジン,④エンパグリフロジ
ン・リナグリプチン配合剤,⑤
カナグリフロジン水和物,⑥テ
ネリグリプチン臭化水素酸塩水
和物・カナグリフロジン水和物
配合剤,⑦ダパグリフロジンプ
ロピレングリコール水和物,⑧ト
ホグリフロジン水和物,⑨ルセ
オグリフロジン水和物 他3件
令和6年12月17日に改訂を指導した医薬品の使用上の注意のうち
重要な副作用等について,改訂内容等とともに改訂の根拠となっ
た症例の概要等に関する情報を紹介します。
10
3
エサキセレノン
使用上の注意の改訂について(その356)
23
4
市販直後調査の対象品目一覧
令和6年11月末日現在,市販直後調査の対象品目を紹介します。
31
他17件
:緊急安全性情報の配布
:安全性速報の配布
:使用上の注意の改訂
:症例の紹介
厚生労働大臣への副作用等報告は,医薬関係者の業務です。
医師,歯科医師,薬剤師等の医薬関係者は,医薬品,医療機器や再生医療等製品による
副作用,感染症,不具合を知ったときは,直接又は当該医薬品等の製造販売業者を通じて
厚生労働大臣へ報告してください。
なお,薬局及び医薬品の販売の従事者も医薬関係者として,副作用等を報告することが
求められています。
報告の際は,是非
をご活用ください。
https://www.pmda.go.jp/safety/reports/hcp/0002.html
416
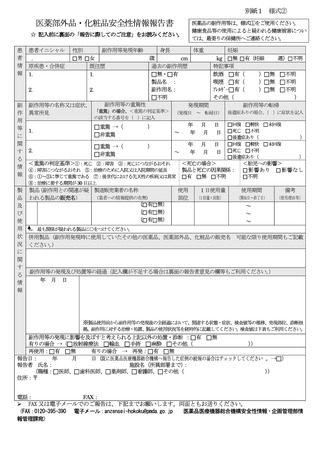
【情報の概要】
No.
医薬品等
対策
情報の概要
頁
1
新型コロナウイルス感染症に対
する経口抗ウイルス薬(ゾコー
バ錠 125mg及びラゲブリオカプ
セル 200mg)の使用上の注意の
改訂について
厚生労働省は,令和6年12月17日に「使用上の注意」の改訂指示
通知を発出し,エンシトレルビル フマル酸(ゾコーバ錠125mg)
及びモルヌピラビル(ラゲブリオカプセル200mg)の製造販売業者
に対して,妊娠する可能性のある女性への投与に際しては,投与
3
の必要性を十分に検討する旨,並びに投与が必要と判断される場
合においても投与開始前に十分な問診により妊娠していないこと及
び妊娠している可能性がないことの確認を行うこと等の注意事項
を追記するよう指示しましたので,その内容等について紹介します。
2
①イプラグリフロジン L-プロ
リン,②シタグリプチンリン酸塩
水和物・イプラグリフロジン L
-プロリン配合剤,③エンパグ
リフロジン,④エンパグリフロジ
ン・リナグリプチン配合剤,⑤
カナグリフロジン水和物,⑥テ
ネリグリプチン臭化水素酸塩水
和物・カナグリフロジン水和物
配合剤,⑦ダパグリフロジンプ
ロピレングリコール水和物,⑧ト
ホグリフロジン水和物,⑨ルセ
オグリフロジン水和物 他3件
令和6年12月17日に改訂を指導した医薬品の使用上の注意のうち
重要な副作用等について,改訂内容等とともに改訂の根拠となっ
た症例の概要等に関する情報を紹介します。
10
3
エサキセレノン
使用上の注意の改訂について(その356)
23
4
市販直後調査の対象品目一覧
令和6年11月末日現在,市販直後調査の対象品目を紹介します。
31
他17件
:緊急安全性情報の配布
:安全性速報の配布
:使用上の注意の改訂
:症例の紹介
厚生労働大臣への副作用等報告は,医薬関係者の業務です。
医師,歯科医師,薬剤師等の医薬関係者は,医薬品,医療機器や再生医療等製品による
副作用,感染症,不具合を知ったときは,直接又は当該医薬品等の製造販売業者を通じて
厚生労働大臣へ報告してください。
なお,薬局及び医薬品の販売の従事者も医薬関係者として,副作用等を報告することが
求められています。
報告の際は,是非
をご活用ください。
https://www.pmda.go.jp/safety/reports/hcp/0002.html