よむ、つかう、まなぶ。
【医薬品・医療機器等安全性情報No.416】 (37 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000185468_00019.html |
| 出典情報 | 医薬品・医療機器等安全性情報 416号(1/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
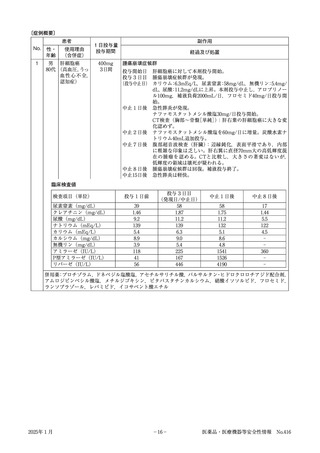
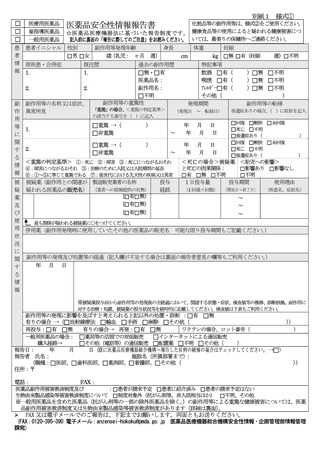
別紙1 様式②
医薬部外品・化粧品安全性情報報告書
医薬品の副作用等は、様式①をご使用ください。
健康食品等の使用によると疑われる健康被害につい
ては、最寄りの保健所へご連絡ください。
☆ 記入前に裏面の「報告に際してのご注意」をお読みください。
患
者
情
報
患者イニシャル
.
原疾患・合併症
1.
2.
副
作
用
等
に
関
す
る
情
報
製
品
及
び
使
用
状
況
に
関
す
る
情
報
性別
男
副作用等発現年齢
女
既往歴
1.
2.
身長
体重
歳
cm
過去の副作用歴
無・ 有
製品名 :
副作用名:
不明
副作用等の重篤性
発現期間
妊娠
無 有(妊娠
週) 不明
kg
特記事項
飲酒
有(
) 無
不明
喫煙
有(
) 無
不明
) 無
不明
アレルギー 有(
その他(
)
副作用等の転帰
副作用等の名称又は症状、
「重篤」の場合、<重篤の判定基準> (発現日 ~ 転帰日) 後遺症ありの場合、
( )に症状を記入
異常所見
の該当する番号を( )に記入
1.
2.
重篤 →(
非重篤
重篤 →(
非重篤
~
年
年
月
月
日
日
~
年
年
月
月
日
日
)
)
<重篤の判定基準>①:死亡 ②:障害 ③:死亡につながるおそれ
④:障害につながるおそれ ⑤:治療のために入院又は入院期間の延長
⑥:①~⑤に準じて重篤である ⑦:後世代における先天性の疾病又は異常
⑧:治療に要する期間が 30 日以上
製品(副作用との関連が疑 製造販売業者の名称
(業者への情報提供の有無)
われる製品の販
販売名)
( 有 無)
( 有 無)
( 有 無)
回復
軽快
死亡
不明
後遺症あり(
回復
軽快
死亡
不明
後遺症あり(
<死亡の場合>
製品と死亡の因果関係:
有
無
不明
使用
部位
未回復
)
未回復
)
<胎児への影響>
影響あり
影響なし
不明
1日使用量
使用期間
備考
(1 回量×回数)
(開始日~終了日)
(使用理由等)
~
~
~
最も関係が疑われる製品に○をつけてください。
併用製品(副作用発現時に使用していたその他の医薬品、医薬部外品、化粧品の販売名 可能な限り使用期間もご記載
ください。
)
副作用等の発現及び処置等の経過(記入欄が不足する場合は裏面の報告者意見の欄等もご利用ください。
)
年 月 日
※製品使用前から副作用等の発現後の全経過において、関連する状態・症状、検査値等の推移、発現部位、診断根
拠、副作用に対する治療・処置、製品の使用状況等を経時的に記載してください。検査値は下表もご利用ください。
副作用等の発現に影響を及ぼすと考えられる上記以外の処置・診断 : 有
無
輸血
手術
麻酔
その他(
)
)
有りの場合 →( 放射線療法
再使用: 有
無
有りの場合 → 再発: 有
無
報告日:
年
月
日(既に医薬品医療機器総合機構へ報告した症例の続報の場合はチェックしてください 。→ )
報告者 氏名:
施設名(所属部署まで)
:
)
)
(職種: 医師、 歯科医師、 薬剤師、 看護師、 その他(
住所:〒
電話:
FAX:
FAX 又は電子メールでのご報告は、下記までお願いします。両面ともお送りください。
(FAX:0120-395-390 電子メール:anzensei-hokoku@pmda.go.jp
医薬品医療機器総合機構安全性情報・企画管理部情
報管理課宛)
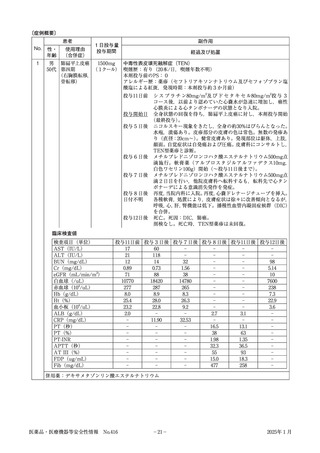
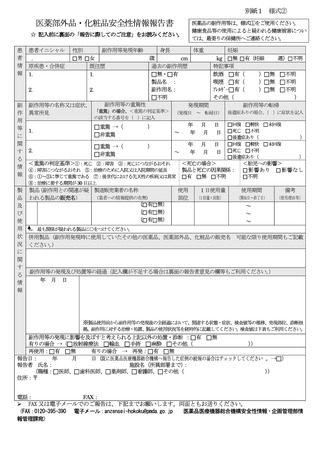
医薬部外品・化粧品安全性情報報告書
医薬品の副作用等は、様式①をご使用ください。
健康食品等の使用によると疑われる健康被害につい
ては、最寄りの保健所へご連絡ください。
☆ 記入前に裏面の「報告に際してのご注意」をお読みください。
患
者
情
報
患者イニシャル
.
原疾患・合併症
1.
2.
副
作
用
等
に
関
す
る
情
報
製
品
及
び
使
用
状
況
に
関
す
る
情
報
性別
男
副作用等発現年齢
女
既往歴
1.
2.
身長
体重
歳
cm
過去の副作用歴
無・ 有
製品名 :
副作用名:
不明
副作用等の重篤性
発現期間
妊娠
無 有(妊娠
週) 不明
kg
特記事項
飲酒
有(
) 無
不明
喫煙
有(
) 無
不明
) 無
不明
アレルギー 有(
その他(
)
副作用等の転帰
副作用等の名称又は症状、
「重篤」の場合、<重篤の判定基準> (発現日 ~ 転帰日) 後遺症ありの場合、
( )に症状を記入
異常所見
の該当する番号を( )に記入
1.
2.
重篤 →(
非重篤
重篤 →(
非重篤
~
年
年
月
月
日
日
~
年
年
月
月
日
日
)
)
<重篤の判定基準>①:死亡 ②:障害 ③:死亡につながるおそれ
④:障害につながるおそれ ⑤:治療のために入院又は入院期間の延長
⑥:①~⑤に準じて重篤である ⑦:後世代における先天性の疾病又は異常
⑧:治療に要する期間が 30 日以上
製品(副作用との関連が疑 製造販売業者の名称
(業者への情報提供の有無)
われる製品の販
販売名)
( 有 無)
( 有 無)
( 有 無)
回復
軽快
死亡
不明
後遺症あり(
回復
軽快
死亡
不明
後遺症あり(
<死亡の場合>
製品と死亡の因果関係:
有
無
不明
使用
部位
未回復
)
未回復
)
<胎児への影響>
影響あり
影響なし
不明
1日使用量
使用期間
備考
(1 回量×回数)
(開始日~終了日)
(使用理由等)
~
~
~
最も関係が疑われる製品に○をつけてください。
併用製品(副作用発現時に使用していたその他の医薬品、医薬部外品、化粧品の販売名 可能な限り使用期間もご記載
ください。
)
副作用等の発現及び処置等の経過(記入欄が不足する場合は裏面の報告者意見の欄等もご利用ください。
)
年 月 日
※製品使用前から副作用等の発現後の全経過において、関連する状態・症状、検査値等の推移、発現部位、診断根
拠、副作用に対する治療・処置、製品の使用状況等を経時的に記載してください。検査値は下表もご利用ください。
副作用等の発現に影響を及ぼすと考えられる上記以外の処置・診断 : 有
無
輸血
手術
麻酔
その他(
)
)
有りの場合 →( 放射線療法
再使用: 有
無
有りの場合 → 再発: 有
無
報告日:
年
月
日(既に医薬品医療機器総合機構へ報告した症例の続報の場合はチェックしてください 。→ )
報告者 氏名:
施設名(所属部署まで)
:
)
)
(職種: 医師、 歯科医師、 薬剤師、 看護師、 その他(
住所:〒
電話:
FAX:
FAX 又は電子メールでのご報告は、下記までお願いします。両面ともお送りください。
(FAX:0120-395-390 電子メール:anzensei-hokoku@pmda.go.jp
医薬品医療機器総合機構安全性情報・企画管理部情
報管理課宛)