よむ、つかう、まなぶ。
【医薬品・医療機器等安全性情報No.416】 (38 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000185468_00019.html |
| 出典情報 | 医薬品・医療機器等安全性情報 416号(1/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
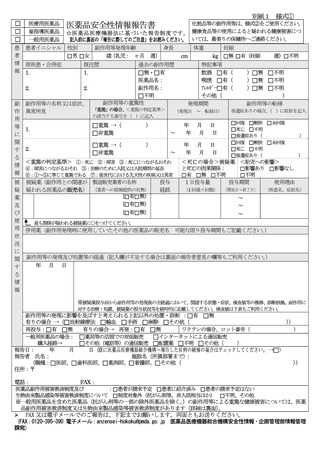
報告者意見(副作用歴、製品使用状況、検査結果、原疾患・合併症等を踏まえ、製品と副作用等との関連性についてご意見をご記載ください。)
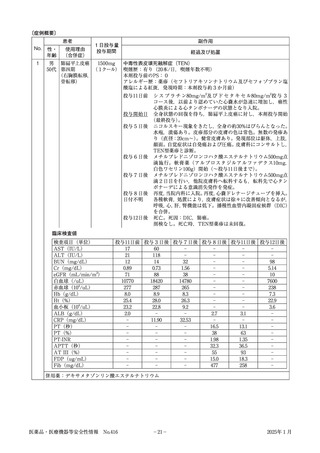
検査値(使用前、発現日、転帰日の副作用等と関係のある検査値等をご記入ください。
)
検査日
/
/
/
/
/
検査項目(単位)
/
「報告に際してのご注意」
この様式は、医薬部外品、化粧品によると疑われる副作用等の健康被害について、医薬関係者が任意でご報
告いただくためのものです。医薬部外品、化粧品との因果関係が必ずしも明確でない場合や、製品の誤用に
よる健康被害の場合もご報告いただけます。
医薬品による副作用及び感染症によると疑われる症例の医薬品、医療機器等の品質、有効性及び安全性の確保
等に関する法律(昭和 35 年法律第 145 号)第 68 条の 10 第2項に基づく報告は、別紙 1 様式①をご使用くだ
さい。
各項目については、可能な限り埋めていただくことで構いません。
報告された情報については、独立行政法人医薬品医療機器総合機構(以下「機構(PMDA)
」という。
)は、情報の
整理又は調査の結果を厚生労働大臣に通知します。また、原則として、機構(PMDA)からその製品の製造販売業
者等へ情報提供しますので、当該製造販売業者が報告を行った医療機関等に対し詳細調査を行う場合があります。
報告された情報について、安全対策の一環として広く情報を公表することがありますが、その場合には、施設名
及び患者のプライバシー等に関する部分は除きます。
健康食品・無承認無許可医薬品による疑いのある健康被害については最寄りの保健所へご連絡ください。
記入欄が不足する場合は、別紙に記載し、報告書に添付いただくか、各欄を適宜拡張して記載願います。
FAX、郵送又は電子メールにより報告いただく場合には、所定の報告用紙のコピーを使用されるか、機構(PMDA)
のウェブサイトから用紙を入手してください。
(https://www.pmda.go.jp/safety/reports/hcp/pmd-act/0002.html)
電子報告システム(報告受付サイト)によりご報告いただく場合には、機構(PMDA)ウェブサイト
(https://www.pmda.go.jp/safety/reports/hcp/0002.html)をご利用ください。
ご報告は医薬品医療機器総合機構安全性情報・企画管理部情報管理課宛にお願いします。両面ともお送りくださ
い。
電子報告システム(報告受付サイト)
:https://www.pmda.go.jp/safety/reports/hcp/0002.html
電子メール:anzensei-hokoku@pmda.go.jp
FAX:0120-395-390
郵送:〒100-0013 東京都千代田区霞が関 3-3-2 新霞が関ビル
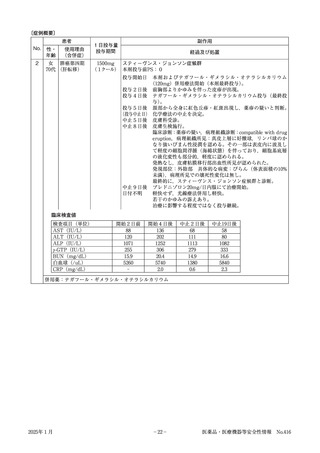
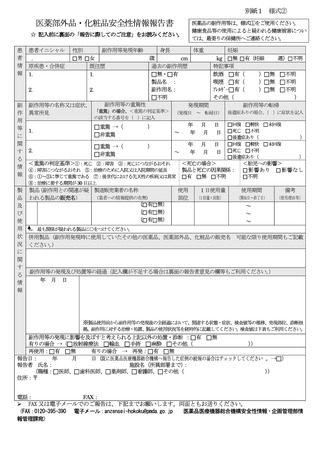
検査値(使用前、発現日、転帰日の副作用等と関係のある検査値等をご記入ください。
)
検査日
/
/
/
/
/
検査項目(単位)
/
「報告に際してのご注意」
この様式は、医薬部外品、化粧品によると疑われる副作用等の健康被害について、医薬関係者が任意でご報
告いただくためのものです。医薬部外品、化粧品との因果関係が必ずしも明確でない場合や、製品の誤用に
よる健康被害の場合もご報告いただけます。
医薬品による副作用及び感染症によると疑われる症例の医薬品、医療機器等の品質、有効性及び安全性の確保
等に関する法律(昭和 35 年法律第 145 号)第 68 条の 10 第2項に基づく報告は、別紙 1 様式①をご使用くだ
さい。
各項目については、可能な限り埋めていただくことで構いません。
報告された情報については、独立行政法人医薬品医療機器総合機構(以下「機構(PMDA)
」という。
)は、情報の
整理又は調査の結果を厚生労働大臣に通知します。また、原則として、機構(PMDA)からその製品の製造販売業
者等へ情報提供しますので、当該製造販売業者が報告を行った医療機関等に対し詳細調査を行う場合があります。
報告された情報について、安全対策の一環として広く情報を公表することがありますが、その場合には、施設名
及び患者のプライバシー等に関する部分は除きます。
健康食品・無承認無許可医薬品による疑いのある健康被害については最寄りの保健所へご連絡ください。
記入欄が不足する場合は、別紙に記載し、報告書に添付いただくか、各欄を適宜拡張して記載願います。
FAX、郵送又は電子メールにより報告いただく場合には、所定の報告用紙のコピーを使用されるか、機構(PMDA)
のウェブサイトから用紙を入手してください。
(https://www.pmda.go.jp/safety/reports/hcp/pmd-act/0002.html)
電子報告システム(報告受付サイト)によりご報告いただく場合には、機構(PMDA)ウェブサイト
(https://www.pmda.go.jp/safety/reports/hcp/0002.html)をご利用ください。
ご報告は医薬品医療機器総合機構安全性情報・企画管理部情報管理課宛にお願いします。両面ともお送りくださ
い。
電子報告システム(報告受付サイト)
:https://www.pmda.go.jp/safety/reports/hcp/0002.html
電子メール:anzensei-hokoku@pmda.go.jp
FAX:0120-395-390
郵送:〒100-0013 東京都千代田区霞が関 3-3-2 新霞が関ビル