よむ、つかう、まなぶ。
別紙1○1 患者申出療養に係る新規技術の科学的評価等について (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00021.html |
| 出典情報 | 患者申出療養評価会議(第36回 12/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
患者申出療養評価会議事前評価構成員からの指摘事項に対する回答
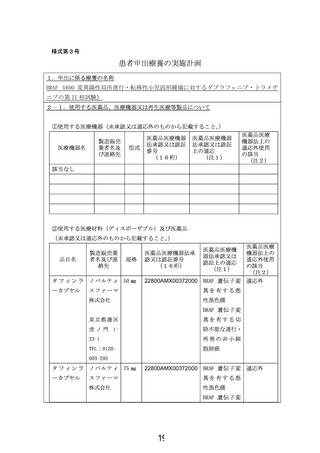
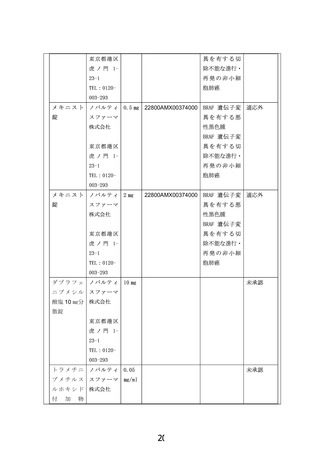
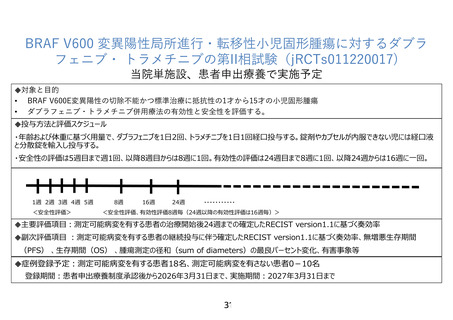
患者申出療養技術名: BRAF V600 変異陽性局所進行・転移性小児固形腫瘍に対するダブラフェニブ・
トラメチニブの第 II 相試験
令和4年12月 17 日
所属・氏名:北海道大学病院 木下一郎
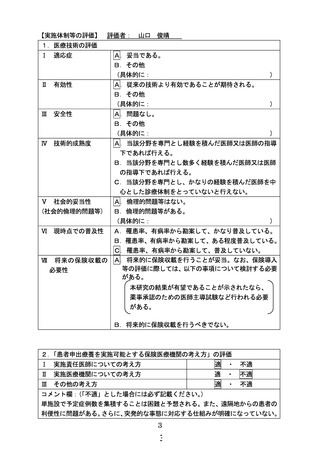
1.単施設で行う理由は何でしょうか。
【回答】
研究対象薬の併用療法に係る安全性プロファイルは国際共同臨床試験で示されていますが、国内で
は治験を含めて小児での使用実績が少ないことを踏まえ、被験者の安全性を確保する十分な情報伝達
体制を確保するためです。これまで当該併用療法に係る安全性プロファイルは小児と成人で一貫してお
り、申請医療機関が成人での当該併用療法の実施経験を有することも理由です。
2.プロトコール 10.3, 10.4, 10.6, 10.7, 10.8 など、研究対象者の同意に関連する項目の記述では、研究
対象者本人である小児被験者の意思確認が無視されており不適切である(すべて、「代諾者」の意
思確認についての検討しかなされていない。)。また、登録時に 15 歳以下の児であっても、本研究期
間中に 16 歳以上に達する小児被験者が生じ得ることから、改めてこうした小児被験者の意思確認を
行うこと、および本人のインフォームド・コンセントを改めて取得することについての計画が欠けてお
り、この点でも不適切である。
【回答】
研究計画書 10.3, 10.6, 10.7, 10.8 に、研究対象者への意思確認についての記載が欠けていましたの
で、各項目に、研究対象者への意思確認を行う方法を記載しました。
10.4 には、「研究対象者が 7 歳以上 15 歳以下の場合は『アセント文書』を用いて研究対象者本人に
対して本研究の説明を行い,研究対象者本人からアセントを文書で取得する。」と記していました。
以上より、7 歳以上 15 歳以下の小児被験者に対するアセント文書のよる意思確認は必ず実施いたし
ます。
本研究期間中に 16 歳以上に達する小児被験者に対して、改めてインフォームド・コンセントを取得す
ることについては、説明文書・同意文書の改訂が行われた場合のみとし、16 歳から成人用の説明同意
文書を用いて再同意を取得します(10.8 説明文書・同意文書の改訂に記載。16 歳から成人用の説明同
意文書を作成。)。
4
10
患者申出療養技術名: BRAF V600 変異陽性局所進行・転移性小児固形腫瘍に対するダブラフェニブ・
トラメチニブの第 II 相試験
令和4年12月 17 日
所属・氏名:北海道大学病院 木下一郎
1.単施設で行う理由は何でしょうか。
【回答】
研究対象薬の併用療法に係る安全性プロファイルは国際共同臨床試験で示されていますが、国内で
は治験を含めて小児での使用実績が少ないことを踏まえ、被験者の安全性を確保する十分な情報伝達
体制を確保するためです。これまで当該併用療法に係る安全性プロファイルは小児と成人で一貫してお
り、申請医療機関が成人での当該併用療法の実施経験を有することも理由です。
2.プロトコール 10.3, 10.4, 10.6, 10.7, 10.8 など、研究対象者の同意に関連する項目の記述では、研究
対象者本人である小児被験者の意思確認が無視されており不適切である(すべて、「代諾者」の意
思確認についての検討しかなされていない。)。また、登録時に 15 歳以下の児であっても、本研究期
間中に 16 歳以上に達する小児被験者が生じ得ることから、改めてこうした小児被験者の意思確認を
行うこと、および本人のインフォームド・コンセントを改めて取得することについての計画が欠けてお
り、この点でも不適切である。
【回答】
研究計画書 10.3, 10.6, 10.7, 10.8 に、研究対象者への意思確認についての記載が欠けていましたの
で、各項目に、研究対象者への意思確認を行う方法を記載しました。
10.4 には、「研究対象者が 7 歳以上 15 歳以下の場合は『アセント文書』を用いて研究対象者本人に
対して本研究の説明を行い,研究対象者本人からアセントを文書で取得する。」と記していました。
以上より、7 歳以上 15 歳以下の小児被験者に対するアセント文書のよる意思確認は必ず実施いたし
ます。
本研究期間中に 16 歳以上に達する小児被験者に対して、改めてインフォームド・コンセントを取得す
ることについては、説明文書・同意文書の改訂が行われた場合のみとし、16 歳から成人用の説明同意
文書を用いて再同意を取得します(10.8 説明文書・同意文書の改訂に記載。16 歳から成人用の説明同
意文書を作成。)。
4
10