よむ、つかう、まなぶ。
別紙1○1 患者申出療養に係る新規技術の科学的評価等について (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00021.html |
| 出典情報 | 患者申出療養評価会議(第36回 12/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
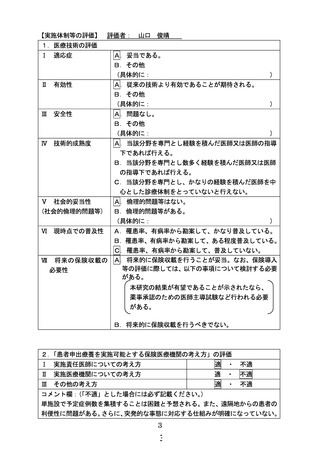
9.患者等に対して重大な事態が生じた場合の対処方法及び補償内容
補償金の有無:
(有・無) 医療費の有無:(有・無)
保険への加入の有無:(
有
医療手当の有無:(有・無)
・ 無 )
その他の措置の内容:保険医療の技術の範囲で最善の医療を提供する。
10.試験に係る記録の取扱い及び管理・保存方法
研究責任医師は、記入手順及び記入上の注意事項等を説明した「症例報告書記入の手引
き」を作成する。症例報告書を作成する者は、その「症例報告書記入の手引き」に従いEDC
システムに入力を行う。(以下、症例報告書作成:EDC システムの入力)
研究責任(分担)医師または研究協力者は、本研究に登録された全ての研究対象者を対象と
して、研究完了まで研究の進捗にあわせて随時 EDC システムの入力を行う。なお、EDC シ
ステムの入力時には、研究対象者の個人情報とは関係のない番号(研究対象者識別コード)
を割り振り、データと個人が特定できるように対応表を作成するが、その対応表は提供せず
実施医療機関で保管する。
研究責任医師は、本研究が終了した日から 5 年間、本研究に関する記録を以下の書類ととも
に保管する。
研究責任医師及び研究分担医師は、
「15.3 項 記録の保管」に規定する記録を研究の終了(中
止)について報告された日から 5 年間、実施医療機関内の鍵付き保管庫にて適切に保管す
る。当該資料を外部業者等に委託し保管する場合は、必要時に随時資料が確認できるよう、
また、規定の保管期間中は適切な条件下にて管理されるよう、契約書等にて取り決めを行う
こととする。
11.患者負担について
患者申出療養にかかる費用として、1症例につき 医師・看護師・薬剤師の人件費 57,923
円、臨床研究支援部門等支援部門に係る費用 554,033 円、合計 611,956 円が必要となる。
本研究で用いる試験薬のコストは供給元であるノバルティスファーマ株式会社が無償提供す
る。
12.起こりうる利害の衝突及び研究者等の関連組織との関わり
本研究の計画及び実施において、ノバルティスファーマ株式会社からの資金提供はない。た
だし、本研究の実施に必要な研究薬については、ノバルティスファーマ株式会社から提供を
受けて実施する。ノバルティスファーマ株式会社は、研究薬の情報の提供には関与するが、
研究の管理・運営、データマネジメント、統計解析及びモニタリングの実施には直接関与し
ない
研究責任医師は、本研究の実施に先立ち、全ての研究責任(分担)医師を対象として、関連
する企業との利益相反の有無について調査を行い、利益相反管理基準及び利益相反管理計画
を作成する。これらの資料を認定臨床研究審査委員会に提出し、審査、承認を得るほか、本
研究実施期間を通じて継続的に利益相反の確認を行い、適切に管理する。
27
補償金の有無:
(有・無) 医療費の有無:(有・無)
保険への加入の有無:(
有
医療手当の有無:(有・無)
・ 無 )
その他の措置の内容:保険医療の技術の範囲で最善の医療を提供する。
10.試験に係る記録の取扱い及び管理・保存方法
研究責任医師は、記入手順及び記入上の注意事項等を説明した「症例報告書記入の手引
き」を作成する。症例報告書を作成する者は、その「症例報告書記入の手引き」に従いEDC
システムに入力を行う。(以下、症例報告書作成:EDC システムの入力)
研究責任(分担)医師または研究協力者は、本研究に登録された全ての研究対象者を対象と
して、研究完了まで研究の進捗にあわせて随時 EDC システムの入力を行う。なお、EDC シ
ステムの入力時には、研究対象者の個人情報とは関係のない番号(研究対象者識別コード)
を割り振り、データと個人が特定できるように対応表を作成するが、その対応表は提供せず
実施医療機関で保管する。
研究責任医師は、本研究が終了した日から 5 年間、本研究に関する記録を以下の書類ととも
に保管する。
研究責任医師及び研究分担医師は、
「15.3 項 記録の保管」に規定する記録を研究の終了(中
止)について報告された日から 5 年間、実施医療機関内の鍵付き保管庫にて適切に保管す
る。当該資料を外部業者等に委託し保管する場合は、必要時に随時資料が確認できるよう、
また、規定の保管期間中は適切な条件下にて管理されるよう、契約書等にて取り決めを行う
こととする。
11.患者負担について
患者申出療養にかかる費用として、1症例につき 医師・看護師・薬剤師の人件費 57,923
円、臨床研究支援部門等支援部門に係る費用 554,033 円、合計 611,956 円が必要となる。
本研究で用いる試験薬のコストは供給元であるノバルティスファーマ株式会社が無償提供す
る。
12.起こりうる利害の衝突及び研究者等の関連組織との関わり
本研究の計画及び実施において、ノバルティスファーマ株式会社からの資金提供はない。た
だし、本研究の実施に必要な研究薬については、ノバルティスファーマ株式会社から提供を
受けて実施する。ノバルティスファーマ株式会社は、研究薬の情報の提供には関与するが、
研究の管理・運営、データマネジメント、統計解析及びモニタリングの実施には直接関与し
ない
研究責任医師は、本研究の実施に先立ち、全ての研究責任(分担)医師を対象として、関連
する企業との利益相反の有無について調査を行い、利益相反管理基準及び利益相反管理計画
を作成する。これらの資料を認定臨床研究審査委員会に提出し、審査、承認を得るほか、本
研究実施期間を通じて継続的に利益相反の確認を行い、適切に管理する。
27